
题目列表(包括答案和解析)
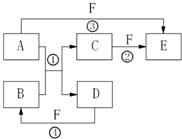 A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件及部分产物未列出).
A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件及部分产物未列出).
| ||
| ||


| ||
| ||
| ||
| ||
A、B、C、D、E、F六种元素均是短周期元素,且原子序数依次增大。B、F原子的最外层电子数均为其电子层数的两倍,D、F元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙均能反应(相对分子质量甲<乙)转化关系如图(反应条件略去),元素E形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题:
(1)写出M与甲的浓溶液加热时反应的化学方程式 。
(2)X、Y、Z、W属于同一类物质,这类化合物固态时的晶体类型为 ;X、Y、W都能与Z反应,则Z的结构式为 。
(3)将X、W与D2按1∶1∶n的物质的量之比通入Z中,充分反应后无气体剩余或生成,则n= ,写出反应的化学方程式 。
(4)化合物ED2与元素B形成的某种单质晶体类型相同,且在高温下能发生置换反应。若反应中B的单质被破坏1 mol共价键,则参加反应的化合物ED2的质量为 g。
(5)元素B的另一种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,则12 g该晶体中含有 NA个正六边形。
A、B、C、D、E、F六种元素均是短周期元素,且原子序数依次增大。B、F原子的最外层电子数均为其电子层数的两倍,D、F元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙均能反应(相对分子质量甲<乙)转化关系如图(反应条件略去),元素E形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题:
(1)写出M与甲的浓溶液加热时反应的化学方程式 。
(2)X、Y、Z、W属于同一类物质,这类化合物固态时的晶体类型为 ;X、Y、W都能与Z反应,则Z的结构式为 。
(3)将X、W与D2按1∶1∶n的物质的量之比通入Z中,充分反应后无气体剩余或生成,则n= ,写出反应的化学方程式 。
(4)化合物ED2与元素B形成的某种单质晶体类型相同,且在高温下能发生置换反应。若反应中B的单质被破坏1 mol共价键,则参加反应的化合物ED2的质量为 g。
(5)元素B的另一种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,则12 g该晶体中含有 NA个正六边形。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com