
题目列表(包括答案和解析)
为了贯彻“循环经济,防止污染”的理念,某校化学课外活动小组利用废干电池作为再生资源。其实验设计如下:

一、实验目的
从废旧电池中提取有用物质,并检验铵盐的纯度。
二、实验材料
废旧1号电池若干节,钳子等实验用品。
三、实验步骤
1.获取铜帽、锌片、石墨电极
2.从黑色混合物的滤液中提取NH4Cl
3.提取二氧化锰
(1)有关干电池的基本构造和工作原理如右上图。
电池总反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+Mn2O3+H2O,干电池工作时负极上的电极反应式为:______________;正极上产生两种气体,则正极的电极反应式为:________________。
(2)用钳子和剪子剪开回收的干电池的锌筒,把铜帽、锌皮和碳棒回收,将电池内的黑色粉末移入小烧杯中。
(3)氯化铵和氯化锌的提取、检验和分离:
①从黑色粉末中提取NH4Cl和ZnCl2等晶体的混合物,主要包括:溶解、_________、蒸发、_________。
②设计简单的实验证明所得晶体中含有 和Zn2+[已知Zn(OH)2是两性氢氧化物且能溶解于氨水生成Zn
和Zn2+[已知Zn(OH)2是两性氢氧化物且能溶解于氨水生成Zn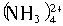 ],并填写下列实验报告。
],并填写下列实验报告。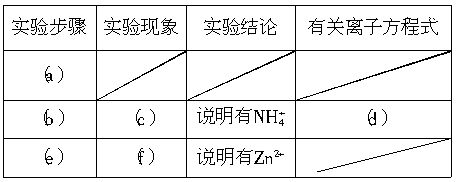
(a)________,(b)___________,(c)__________,(d)__________,(e)__________,(f)___________。
③最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要硅酸盐质仪器除酒精灯外还有___________。
(4)晶体中氯化铵质量分数的测定:
已知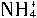 与HCHO在水溶液中有如下反应:4
与HCHO在水溶液中有如下反应:4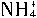 +6HCHO→(CH2)6N4+4H++6H2O。称取ag样品溶于水,加入足量的HCHO溶液,配成100mL溶液,再取出10mL,滴入酚酞后,再逐滴滴入cmol/L的NaOH溶液,当滴到VmL时,溶液呈现粉红色,整个过程中不考虑杂质参与反应,则晶体中氯化铵的质量分数ω(NH4Cl)为___________。
+6HCHO→(CH2)6N4+4H++6H2O。称取ag样品溶于水,加入足量的HCHO溶液,配成100mL溶液,再取出10mL,滴入酚酞后,再逐滴滴入cmol/L的NaOH溶液,当滴到VmL时,溶液呈现粉红色,整个过程中不考虑杂质参与反应,则晶体中氯化铵的质量分数ω(NH4Cl)为___________。
名称 | 分子式 | 颜色、状态 | 溶解性/g | 熔点/℃ | 密度/g·cm-3 |
乙二酸 | H2C2O4 | —— | 8.6(20℃) | 189.5 | 1.900 |
二水合乙二酸 | H2C2O4·2H2O | 无色晶体 | —— | 101.5 | 1.650 |
注:表中“——”表示尚未有具体数据。
回答下列问题:
(1)向盛有Na2CO3粉末的试管里加入约3 mL乙二酸溶液,观察到的现象为_____________;说明乙二酸的酸性比碳酸____________。
(2)向盛有5 mL乙二酸饱和溶液的试管中滴入3滴硫酸酸化的0.5%(质量分数)的KMnO4溶液,振荡,观察到现象为_______________________________________________________;说明乙二酸有______________________。
(3)向A试管中加入3 mL乙醇,然后,边振荡试管边加入2 mL 浓硫酸和2 mL乙二酸,按图甲连接好装置,加热3—5 min,在B试管中有油状、香味液体产生。该现象说明发生了______________(填有机反应类型)反应。在B试管中加入饱和Na2CO3溶液的目的是_______________________________________________________________。
导管在液面上的原因是________________________________________________。

(4)图乙是中学化学实验常用的装置,用此装置可制备的气体有___________(填标号)。
A.O2 B.H2 C.Cl2 D.NH3 E.CH2====CH2 F.CH![]() CH
CH
图乙试管口略低于试管底部的原因是_________________________________________。已知草酸分解的化学方程式为H2C2O4![]() H2O+CO2↑+CO↑。用图丙加热草酸晶体,验证草酸受热分解及其产物,图丙是中学化学教材中给出的实验装置图,但有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,指出图丙不合理的原因。
H2O+CO2↑+CO↑。用图丙加热草酸晶体,验证草酸受热分解及其产物,图丙是中学化学教材中给出的实验装置图,但有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,指出图丙不合理的原因。
答:______________________________________________________________。
该装置也不符合绿色化学的要求,因为________________________________________。
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等
| | | J | | |
| | | | | R |
| | I1 | I2 | I3 | I4 | …… |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 | …… |
碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l);△H1= —1214kJ/mol
②2CO(g)+O2(g)=2CO2(g);△H2= —566kJ/mol
则反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H= 。
(2)①将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其正极电极反应式是: 。
②某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-→H2↑
③若将 所得Fe(OH)2沉淀暴露在空气中,反应的化学方程式为 。
所得Fe(OH)2沉淀暴露在空气中,反应的化学方程式为 。
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | a | b | c | 1 |
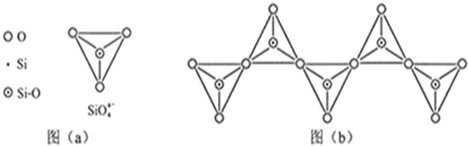
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 、电子数为 。
(2)硅主要以硅酸盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能(KJ/mol) | 356 | 413 | 336 | 226 | 318 | 452 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com