
题目列表(包括答案和解析)
氮是地球上极为丰富的元素.填写下列空白.
(1)NH![]() 中N原子的杂化轨道类型为________,
中N原子的杂化轨道类型为________,
NH![]() 的空间构型为________.
的空间构型为________.
(2)常温下,锂可与氮气直接反应生成Li3N,Li3N晶体中氮以N3-存在,基态N3-的电子排布式为:________,Li3N晶体属于________晶体(填晶体类型).
(3)NH3的沸点为234K,NF3的沸点为154K,两者结构相似,NH3的沸点高于NF3的原因是:________.
(4)CO与N2相似,分子中都存在一个共价叁键,CO含________个π键.下表为CO与N2的相关信息.根据表中数据,说明CO比N2活泼的原因:________.

(5)根据下表数据,写出氮气与氢气反应生成氨气的热化学方程式________.
![]()
(6)CO与N2互为等电子体,其碳原子上有一对孤对电子,因此可作配体,如:Fe(CO)5、Ni(CO)4、Cr(CO)6等,在合成氨工业上中用铜洗液吸收CO,反应如下:

①基态Fe原子的未成对电子数有________个,
写出Cr、Cu+的价层电子排布式.________、________.
②醋酸二氨合铜(I)和醋酸羰基三氨合铜(I)都是配合物,[Cu(NH3)3CO]+中提供孤对电子的分子是:________,接受孤对电子的离子是:________,用箭号标出[Cu(NH3)2]+形成的配位键:________,[Cu(NH3)2]+中两个配位键的键角为180°,则Cu+采取________杂化与NH3形成配位键(填杂化类型).
③Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂.推测Ni(CO)4是________分子(填“极性”或“非极性”).
(7)氮化硅是一种高温陶瓷材料,它硬度大、熔点高、化学性质稳定.
①氮化硅晶体属于________晶体(填晶体类型);
②已知氮化硅晶体结构中,原子间都以共价键相连,且N原子与N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子结构,请写出氮化硅的化学式:________.
(8)极纯的氮气可由叠氮化钠(NaN3)加热分解而得到.2NaN3(s)=2Na(l)+3N2(g),反应过程中,断裂的化学键是离子键和共价键,形成的化学键有________.
下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。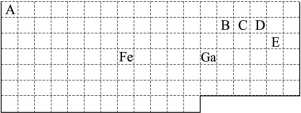
根据信息回答下列问题。
(1)周期表中基态Ga原子的最外层电子排布式为 。
(2)Fe元素位于周期表的 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为 ;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 和 (填化学式)。
(3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有 。
(4)根据VSEPR理论预测ED4-离子的空间构型为 。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为 (写2种)。
下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。
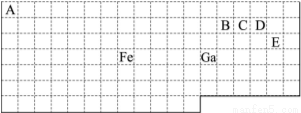
根据信息回答下列问题。
(1)周期表中基态Ga原子的最外层电子排布式为 。
(2)Fe元素位于周期表的 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为 ;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 和 (填化学式)。
(3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有 。
(4)根据VSEPR理论预测ED4-离子的空间构型为 。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为 (写2种)。

研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是 ,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是 ,原因是 。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式: 。
| 电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
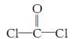 ,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。
,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com