
题目列表(包括答案和解析)




海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(1)在光照条件下,氯气和氢气反应过程如下:
①Cl2→Cl+Cl
②Cl+H2→HCl+H
③H+Cl2→HCl+Cl……
反应②中形成的化合物的电子式为________;反应③中被破坏的化学键属于________键(填“极性”或“非极性”).
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是________(用元素符号表示).与氯元素同周期且金属性最强的元素位于周期表的第________周期________族.
(3)卤素单质及化合物在许多性质上都存在着递变规律.下列有关说法正确的是________.
a.卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深
b.卤化氢的键长按H-F、H-Cl、H-Br、H-I的顺序依次减小
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
(4)卤素单质的键能大小如图.由图推断:
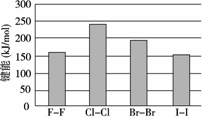
①非金属性强的卤素,其单质分子的化学键________断裂(填“容易”或“不容易”或“不一定容易”).
②卤素单质键能大小与键长的关系为:________.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
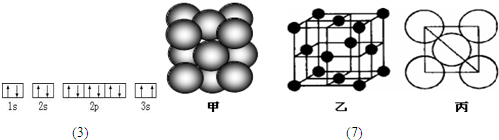
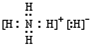
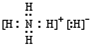
(15分)A、G、J均为非金属单质,工业上利用反应①来冶炼与A同主族元素G单质的粗产品。K为无色液体,D是一种常见金属,溶于某无氧酸中得到H溶液,该无氧酸的阴离子在同主族元素形成的简单阴离子中还原性最强(除放射性元素)。其物质间转化关系如下图:(部分反应物和生成物略去)
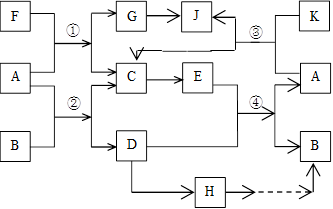
(1)写出下列物质的化学式B______, F_______,H______。A和G的最简单气态氢化物中,较稳定的物质是 (填化学式),写出反应①的化学方程式 。
(2)反应②是工业上冶炼金属D的方法之一,然而目前世界上60%的D单质是从海水中提取的。以下是海水中提炼金属D的简易流程图(结合工业生产实际,在括号内填写需要加入物质的化学式,方框内填写生成物质的化学式)

(3)海带中含有H的阴离子,常用过氧化氢、稀硫酸和淀粉来检验其阴离子,其主要反应的离子方程式为 。
(4)写出G→J的化学方程式________________________________________,某同学利用了某技巧首先配平了G和J的系数,下列关系符合此技巧且正确的是_________
A.反应①:F:G=1:1 B.反应②:A:D=1:1
C.反应③:A:J=2:1 D.反应④:E:B =1:1
(15分)A、G、J均为非金属单质,工业上利用反应①来冶炼与A同主族元素G单质的粗产品。K为无色液体,D是一种常见金属,溶于某无氧酸中 得到H溶液,该无氧酸的阴离子在同主族元素形成的简单阴离子中还原性最强(除放射性元素)。其物质间转化关系如下图:(部分反应物和生成物略去)
得到H溶液,该无氧酸的阴离子在同主族元素形成的简单阴离子中还原性最强(除放射性元素)。其物质间转化关系如下图:(部分反应物和生成物略去)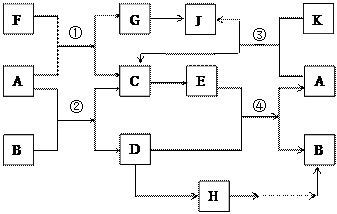
(1)写出下列物质的化学式B______, F_______, H______。A和G的最简单气态氢化物中,较稳定的物质是 (填化学式),写出反应①的化学方程式 。
(2)反应②是工业上冶炼金属D的方法之一,然而目前世界上60%的D单质是从海水中提取的。以下是海水中提炼金属D的简易流程图(结合工业生产实际,在括号内填写需要加入物质的化学式,方框内填写生成物质的化学式)
(3)海带中含有H的阴离子,常用过氧化氢、稀硫酸和淀粉来检验其阴离子,其主要反应的离子方程式为 。
(4)写出G→J的化学方程式________________________________________,某同学利用了某技巧首先配平了G和J的系数,下列关系符合此技巧且正确的是_________
A.反应①:F:G="1:1 " B.反应②:A:D=1:1
C.反应③:A:J="2:1 " D.反应④:E:B =1:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com