
题目列表(包括答案和解析)
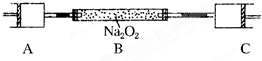 80℃,101kPa下,用如图装置进行如下实验?A?C两筒内分别装有无色气体,它们可能是NH3?O2?N2?H2S?NO?CO2等气体,B筒内装有Na2O2固体,推动A的活塞,A筒内气体缓缓地全部通过B后进入C筒,C筒内气体由无色变为红棕色,但其体积换算成同温同压下却并未变化?(不考虑2NO2═N2O4)
80℃,101kPa下,用如图装置进行如下实验?A?C两筒内分别装有无色气体,它们可能是NH3?O2?N2?H2S?NO?CO2等气体,B筒内装有Na2O2固体,推动A的活塞,A筒内气体缓缓地全部通过B后进入C筒,C筒内气体由无色变为红棕色,但其体积换算成同温同压下却并未变化?(不考虑2NO2═N2O4)| 时间(s) n(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/mol?L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
| A、升高温度该反应的平衡常数K减小 |
| B、20~40s 内,v(N2O4)=0.004mol?L-1?s1 |
| C、反应达平衡时,吸收的热量为0.30Q kJ |
| D、100s时再通入0.40mol N2O4,达新平衡时N2O4的转化率增大 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com