
题目列表(包括答案和解析)
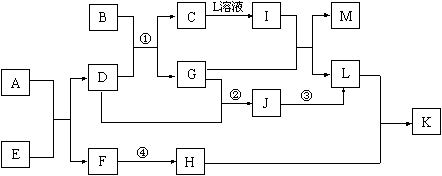
已知A—L所代表的物质(或溶液中的溶质)都是中学化学里常见的物质。通常状况下,A是淡黄色固体,D是气体单质,E是无色无味气体,K是不溶于水的酸。反应①②③是以B为原料生产化学工业重要产品的全部反应,反应④是工业生产普通玻璃的反应之一。一定条件下,各物质间的相互转化关系如下图所示(反应时加入或生成的水均没标出)。
请填写下列空白:
(1)写出下列物质的化学式:A__________;B __________;L 。
(2)画出A中金属元素的原子结构示意图_____________;指出E分子中共价键的类型(填“极性键”或“非极性键”)____________。
(3)完成下列反应方程式:
① I+G→M+L的离子方程式:____________________ ____________________。
② 写出反应④的化学方程式: ______________________ _。
已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。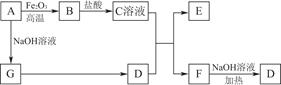
请回答下列问题:
(1)写出F的电子式:____________。
(2)①C溶液与D反应的离子方程式为________________________________________________________________________________________________________________________________________________;
②F溶液与NaOH溶液共热反应的化学方程式为________________________________________________________________________________________________________________________________________________。
(3)①请用离子方程式解释C溶液为何显酸性:________________________________________________________________________________________________________________________________________________,
②F溶液中离子浓度由大到小的顺序为________________________________________________________________________。
(4)将5.4 g A投入200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是________(填代号)。
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1 mol N2和3 mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2 mol/(L·min),则v(D)=________mol/(L·min)。
②在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5 mol G达到平衡后,D的物质的量浓度________(填“大于”“小于”或“等于”)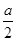 mol/L。
mol/L。
③该条件下的平衡常数为__________________(用含a的代数式表示)。
已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。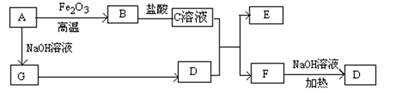
请回答下列问题:
(1)写出F的电子式 ;
(2)①C溶液与D反应的离子方程式为 ;
②F溶液与NaOH溶???共热反应的化学方程式为 ;
(3)①请用离子方程式解释C溶液为何显酸性 ;
②F溶液中离子浓度由大到小的顺序为 ;
(4)将5.4gA投入200mL 2.0mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是 (填代号)
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1molN2和3molG及催化剂充入容积为2L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2mol/(L·min),则v(D)= mol/(L·min)
②在其他条件不变的情况下,若起始时充入0.5molN2和1.5molG达到平衡后,D的物质的量浓度 (填“大于”、“小于”或“等于”)a/2 mol/L。
③该条件下的平衡常数为 (用含a的代数式表示)
已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。
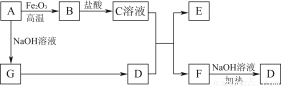
请回答下列问题:
(1)写出F的电子式:____________。
(2)①C溶液与D反应的离子方程式为________________________________________________________________________________________________________________________________________________;
②F溶液与NaOH溶液共热反应的化学方程式为________________________________________________________________________________________________________________________________________________。
(3)①请用离子方程式解释C溶液为何显酸性:________________________________________________________________________________________________________________________________________________,
②F溶液中离子浓度由大到小的顺序为________________________________________________________________________。
(4)将5.4 g A投入200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是________(填代号)。
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1 mol N2和3 mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2 mol/(L·min),则v(D)=________mol/(L·min)。
②在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5 mol G达到平衡后,D的物质的量浓度________(填“大于”“小于”或“等于”)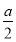 mol/L。
mol/L。
③该条件下的平衡常数为__________________(用含a的代数式表示)。

一、选择题(16×3分=48 分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答案
D
A
C
D
B
B
A
B
D
D
C
A
D
B
C
B
二、第II卷(非选择题 共52分)
17.(共7分,方程式2分,其余每空1分)
(1)①将石蕊试纸湿润 ②检验容量瓶是否漏水
(2)过量的CO2 CO2+Na CO
CO +H2O=2NaHCO3
+H2O=2NaHCO3
(3)氨水 Ag(NH3)2Cl
18.(10分,方程式3分,其余每空2分)
(1)H2O2的电子式 (2离子晶体
(3)HSO3― + H+ = SO2 ↑ + H2O
(4)2NaClO = 2NaCl + O2↑
19.(14分) (1)FeS2 (1分) O3和O2 (1分)
(2) 离子键 非极性共价键 (2分) O=C=O (1分)
(3)①②③ (3分)
(4)2Fe3++SO2十2H2O=SO42-十2Fe2++4H+ (2分)
Na2CO3+SiO2 Na2SiO3+CO2↑ (2分)
Na2SiO3+CO2↑ (2分)
(5) 0.2mol (2分)
20.(12分)实验一 在常温下H2O2分解少或不分解 (2分)
实验二 ①在实验一中加少量的Al2O3 (2分)
② 将带火星的木条置于试管口(2分)
(4) 过滤 (1分) 称量Al2O3的质量 (1分)
(5) 化学性质是否改变 (1分)
(6) 产生气泡速率快慢 (1分) 控制阴离子相同,排除干扰 (1分)
将FeCl3改为Fe2(SO4)3 (1分)
21.(9分) (1)
(3)盐酸的物质的量浓度 (2分)
(4) <
V(CO2)<
<
V(CO2)< (3分)
(3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com