
题目列表(包括答案和解析)
已知反应:mX(g)+ nY(g) qZ(g) △H<0,m+n>q,在恒容的密闭容器中反应达到平衡时,下列说法正确的是( )
A、通入稀有气体,压强增大,平衡正向移动
B、X的正反应速率是Y的逆反应速率的m/n倍
C、降低温度,混合气体的平均相对分子质量变小
D、增加X的物质的量,Y的转化率降低
【解析】考查外界条件对平衡的影响。该反应是体积减小的放热的可逆反应,若降低温度,则平衡向正反应方向移动,所以混合气体的平均相对分子质量变大,C不正确。通入稀有气体,压强增大,但物质的浓度没有变化,平衡不移动,A不正确。增加X的物质的量,可以增大其他物质的转化率,D也不正确。平衡时正逆反应速率相等,所以根据反应速率之比是相应的化学计量数之比可判断,B是正确的。答案选B。
已知反应:mX(g)
+ nY(g)  qZ(g) △H<0,m+n>q,在恒容的密闭容器中反应达到平衡时,下列说法正确的是
( )
qZ(g) △H<0,m+n>q,在恒容的密闭容器中反应达到平衡时,下列说法正确的是
( )
A、通入稀有气体,压强增大,平衡正向移动
B、X的正反应速率是Y的逆反应速率的m/n倍
C、降低温度,混合气体的平均相对分子质量变小
D、增加X的物质的量,Y的转化率降低
【解析】考查外界条件对平衡的影响。该反应是体积减小的放热的可逆反应,若降低温度,则平衡向正反应方向移动,所以混合气体的平均相对分子质量变大,C不正确。通入稀有气体,压强增大,但物质的浓度没有变化,平衡不移动,A不正确。增加X的物质的量,可以增大其他物质的转化率,D也不正确。平衡时正逆反应速率相等,所以根据反应速率之比是相应的化学计量数之比可判断,B是正确的。答案选B。
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为:
CH2=CH2(g)+ H2O(g)![]() CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是
CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是
A.减小压强 B.增大压强 C.分离除乙醇 D.升高温度
【解析】要提高乙烯的转化率,则平衡必须向正反应方向移动。A和C会降低反应速率,升高温度,平衡向逆反应方向移动,所以正确的答案是B。
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为:
CH2=CH2(g)+ H2O(g) CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是
CH3CH2OH(g)△H <0,达到平衡时,要使反应速率加快,同时乙烯的转化率提高,应采取的措施是
A.减小压强 B.增大压强 C.分离除乙醇 D.升高温度
【解析】要提高乙烯的转化率,则平衡必须向正反应方向移动。A和C会降低反应速率,升高温度,平衡向逆反应方向移动,所以正确的答案是B。
(18分)1.已知一般钾盐均为可溶性的强电解质。在某溶液中可发生下列反应: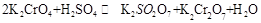
(1)试将上述反应改写成离子议程式
(2)该离子反应的平衡常数表达式为:K= ;
(3)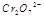 在水溶液中为红色,
在水溶液中为红色,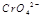 在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
在水溶液中为黄色。某条件下该反应建立平衡后,体系为两种离子的混合液,颜色为橙色。
若加水将其稀释,溶液颜色将偏 (红、黄)原因是
;
若在在上述平衡体系的溶液中中加入硫酸钾固体体系颜色有何变化?为什么?
Ⅱ.固定和利用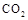 ,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用
,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用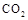 来生产甲醇燃料的方法,该方法的化学方程式是:
来生产甲醇燃料的方法,该方法的化学方程式是:
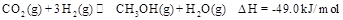
某科学实验将6mol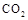 和8molH
和8molH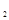 充入一容积为2L的密闭容器中,测得H
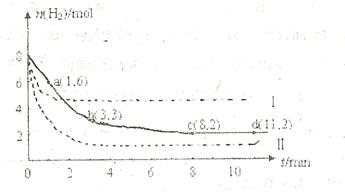
充入一容积为2L的密闭容器中,测得H 的物质的量随时间变化如右图中实线所示(图中字母后数字表示对应的坐标):
的物质的量随时间变化如右图中实线所示(图中字母后数字表示对应的坐标):
问题:
(1)由图分析,在下列时间段内反应速率最快的时间段是 (填答案编号)。
a.0~1min b.1~3min c.3~8min d.8~11min
(2)仅改变某一条件再进行实验,测得H 的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是
,曲线Ⅱ改变的条件可能是
的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是
,曲线Ⅱ改变的条件可能是
。
(3)下列表述能表示该反应已达平衡的是 (填答案编号)
a.容器内压强不再改变 b.容器内气体的密度不再改变
c.容器内气体平均摩尔质量不再改变 d.容器内各物质的物质的量相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com