
题目列表(包括答案和解析)
(22分)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=—99kJ·mol—1.请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中△H= KJ·mol—1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(4)(2分)如果反应速率υ(SO2)为0.05 mol·L—1·min—1,则υ(O2)= mol·L—1·min—1、
υ(SO3)= mol·L—1·min—1;
(5)(2分)已知单质硫的燃烧热为296 KJ·mol—1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
(6)甲烷燃料电池 (KOH作电解质溶液)
负极反应方程式是:
正极反应方程式是:
总反应方程式是:
(7)(2分)常温下,设pH 均为5的H2SO4和A12(SO4)3溶液中由水电离出的c(H+)分别为c1 、c2,则c1:c2= 。
(8)(2分)浓度为0.5 mol/L的盐酸与等浓度的氨水溶液反应,使溶液呈中性,则混合前体积V酸________V碱(填“大于”、“小于”或“等于”)
(9)(2分)取10 mL溶液0.5 mol/L的盐酸,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________。
(22分)2SO2(g)+O2(g) 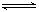 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol的ΔH=—99kJ·mol—1.请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol的ΔH=—99kJ·mol—1.请回答下列问题: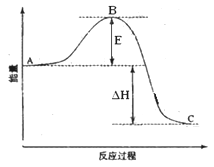
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中△H= KJ·mol—1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(4)(2分)如果反应速率υ(SO2)为0.05 mol·L—1·min—1,则υ(O2)= mol·L—1·min—1、
υ(SO3)= mol·L—1·min—1;
(5)(2分)已知单质硫的燃烧热为296 KJ·mol—1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
(6)甲烷燃料电池(KOH作电解质溶液)
负极反应方程式是:
正极反应方程式是:
总反应方程式是:
(7)(2分)常温下,设pH 均为5的H2SO4和A12(SO4)3溶液中由水电离出的c(H+)分别为c1、c2,则c1:c2= 。
(8)(2分)浓度为0.5 mol/L的盐酸与等浓度的氨水溶液反应,使溶液呈中性,则混合前体积V酸________V碱(填“大于”、“小于”或“等于”)
(9)(2分)取10 mL溶液0.5 mol/L的盐酸,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________。
(22分)2SO2(g)+O2(g) 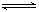 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=—99kJ·mol—1.请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=—99kJ·mol—1.请回答下列问题:
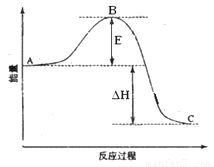
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中△H= KJ·mol—1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(4)(2分)如果反应速率υ(SO2)为0.05 mol·L—1·min—1,则υ(O2)= mol·L—1·min—1、
υ(SO3)= mol·L—1·min—1;
(5)(2分)已知单质硫的燃烧热为296 KJ·mol—1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
(6)甲烷燃料电池 (KOH作电解质溶液)
负极反应方程式是:
正极反应方程式是:
总反应方程式是:
(7)(2分)常温下,设pH 均为5的H2SO4和A12(SO4)3溶液中由水电离出的c(H+)分别为c1 、c2,则c1:c2= 。
(8)(2分)浓度为0.5 mol/L的盐酸与等浓度的氨水溶液反应,使溶液呈中性,则混合前体积V酸________V碱(填“大于”、“小于”或“等于”)
(9)(2分)取10 mL溶液0.5 mol/L的盐酸,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________。
下表A栏中所列各种物质(括号内为少量杂质),在B中选择除杂的方法,在C中选择一种鉴别杂质是否除净的方法.(将序号填入表格中)
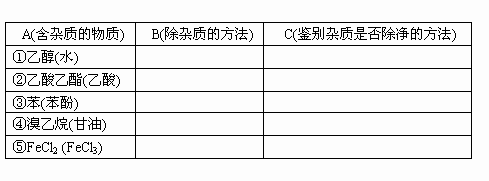
B:(1)过滤 (2)渗析 (3)加入新制CaO后蒸馏 (4)多次水洗分液 (5)加入NaOH溶液振荡后分液 (6)加入饱和Na2CO3溶液振荡后分液 (7)蒸馏 (8)结晶 (9)加入浓溴水产生白色沉淀 (10)加入适量铁粉
C:(a)加入BaCl2产生白色沉淀 (b)加入FeCl3溶液呈紫色 (c)加入AgNO3溶液产生白色沉淀 (d)加入无水CuSO4粉末呈蓝色 (e)加入新制Cu(OH)2悬浊液振荡后呈绛蓝色 (f)使蓝色石蕊试液变红 (g)加入KSCN溶液后呈血红色 (h)加入碘水变蓝
11.6 gFe3O4加到100 mL某浓度的盐酸中,再加入9.8 g铁粉,反应停止时,溶液中无固体存在。向溶液中滴加硫氰化钾溶液,未见颜色变化,为了中和过量的盐酸(不考虑盐酸的挥发),且使铁完全转化成Fe(OH)2,共消耗5.0 mol·L-1NaOH溶液160mL。则原盐酸的物质的量浓度为( )
A.2 mol·L-1 B.4 mol·L-1 C.6 mol·L-1 D.8 mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com