
题目列表(包括答案和解析)
| 0.54g |
| 56+35.5x |
| 0.54g |
| 56+35.5x |
一定温度下,4个容器均为1L的容器中,分别进行反应:C(s)+H2O(g) 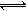 CO(g)+H2(g) △H=+131.3KJ.mol-1[各容器中C(s)均足量],在某时刻测得有关物质的浓度及正、逆反应速率的关系如下表。下列说法不正确的是
CO(g)+H2(g) △H=+131.3KJ.mol-1[各容器中C(s)均足量],在某时刻测得有关物质的浓度及正、逆反应速率的关系如下表。下列说法不正确的是 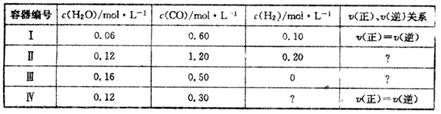
A.在容器Ⅱ中,v(正)<v(逆)
B.在容器Ⅳ中,H2的浓度为0.40 mol.L-1
C. 在容器Ⅲ中, 反应达到平衡时吸收的热量为13.13 KJ
D.若将平衡时容器Ⅰ、Ⅳ中的物质混合于容积为1L的容器中,则反应仍处于平衡状态
①v(A)=0.15 mol·L-1·min-1,
②v(B)=0.01 mol·L-1·s-1,
③v(C)=0.40 mol·L-1·min-1,
④v(D)=0.45 mol·L-1·min-1。该反应进行的快慢顺序为______________。(填序号)
A.1 B.2 C.3 D.4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com