
题目列表(包括答案和解析)
碳是形成化合物最多的元素。
(1)由碳元素参与形成的物质多为分子晶体,也有少数原子晶体。下列关于分子晶体和原子晶体的说法正确的是 (填字母序号)。
A、完全由非金属元素形成的物质一定是分子晶体或原子晶体
B、分子晶体中分子之间一定存在范德华力
C、SiC具有极高的熔点和较大的硬度,SiC分子中除存在共价键外,还存在分子间作用力
D、金刚石是由碳元素形成的原子晶体,性质稳定,不与任何物质反应
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如图所示。下列说法正确的是 。
A、C4属于一种新型的化合物 B、C4与P4(白磷)的晶体都属于分子晶体
C、C4气体分子内含有极性共价键 D、C4与C60互为同素异形
(3)与碳同主族元素锗为32号元素,与锗同周期,且未成对电子数与锗相同,电负性最大的元素的价电子排布式为 。
(4)邻硝基苯酚的熔点 对硝基苯酚(填“>”、“=”或“<”=)。
(5)硼、碳、氮、氧是元素周期表第二周期相邻的四种元素。下列有关的四种化合物中,键角最小的是 。
A、CO2 B、CF4 C、NF3 D、OF2
已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸,可以用硼酸在水溶液中的电离平衡解释它是一元弱酸的原因。
请写出下面这个方程式右端的两种离子的表达式: 。
。
碳是形成化合物最多的元素。
(1)由碳元素参与形成的物质多为分子晶体,也有少数原子晶体。下列关于分子晶体和原子晶体的说法正确的是 (填字母序号)。
A、完全由非金属元素形成的物质一定是分子晶体或原子晶体
B、分子晶体中分子之间一定存在范德华力
C、SiC具有极高的熔点和较大的硬度,SiC分子中除存在共价键外,还存在分子间作用力
D、金刚石是由碳元素形成的原子晶体,性质稳定,不与任何物质反应
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如图所示。下列说法正确的是 。

A、C4属于一种新型的化合物 B、C4与P4(白磷)的晶体都属于分子晶体
C、C4气体分子内含有极性共价键 D、C4与C60互为同素异形
(3)与碳同主族元素锗为32号元素,与锗同周期,且未成对电子数与锗相同,电负性最大的元素的价电子排布式为 。
(4)邻硝基苯酚的熔点 对硝基苯酚(填“>”、“=”或“<”=)。
(5)硼、碳、氮、氧是元素周期表第二周期相邻的四种元素。下列有关的四种化合物中,键角最小的是 。
A、CO2 B、CF4 C、NF3 D、OF2
已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸,可以用硼酸在水溶液中的电离平衡解释它是一元弱酸的原因。
请写出下面这个方程式右端的两种离子的表达式:
 。
。
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |
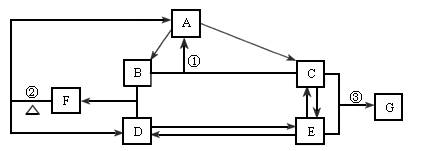
已知:F可用作化肥,也可用来制炸药;纯净的G是一种无色或淡黄色的晶体。据此判断:
(1)单质A必定是________(填“金属”或“非金属”),理由是________。
(2)指出反应①在现代化学工业上的实际意义________。
(3)已知反应②是氧化还原反应,其氧化产物与还原产物的质量比为________。
(4)写出反应③的离子方程式________。
(5)下列哪些属于物质G的用途________。
a.用于印染、漂白行业
b.粘合剂
c.防腐剂
d.“钡餐”
e.常用的混凝土掺和剂、防冻剂
f.加入NaI或KIO3后可作“碘盐”用
下图是某元素的单质及其重要化合物在一定条件下相互转化的关系图(生成物中不含该元素的物质均已略去)。

已知:F可用作化肥,也可用来制炸药;纯净的G是一种无色或淡黄色的晶体。据此判断:
(1)单质A必定是________(填“金属”或“非金属”),理由是________。
(2)指出反应①在现代化学工业上的实际意义________。
(3)已知反应②是氧化还原反应,其氧化产物与还原产物的质量比为________。
(4)写出反应③的离子方程式________。
(5)下列哪些属于物质G的用途________。
a.用于印染、漂白行业
b.粘合剂
c.防腐剂
d.“钡餐”
e.常用的混凝土掺和剂、防冻剂
f.加入NaI或KIO3后可作“碘盐”用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com