
题目列表(包括答案和解析)
| ||
根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量么![]() (近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量
(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量![]() m(H20),由此计算
m(H20),由此计算![]() 。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
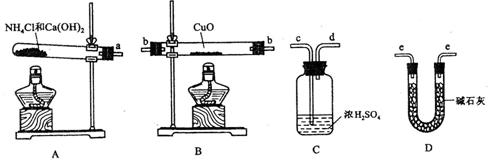
请回答下列问题:[来源:学§科§网Z§X§X§K]
(1)氨气还原炽热氧化铜的化学方程式为________________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→______________________________;
(3)在本实验中,若测得m(CuO)= a g,m(H2O)= b g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大![]() 的是_______________ (填序号);
的是_______________ (填序号);
![]() Cu0未完全起反应 ② CuO不
Cu0未完全起反应 ② CuO不![]() 干燥
干燥
![]() Cu0中混有不反应的杂质 ④ 碱石灰不干燥
Cu0中混有不反应的杂质 ④ 碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定_______________和_______________,或__________![]() _____和_______________达到实验目的。
_____和_______________达到实验目的。
选考题(请考生在第18、19、20三题中任选一题做答,如果多做,则按所做的第一题计分。做答时用2B铅笔在答题卡上把所选题目的题号涂黑)。
第18、19、20三题的第Ⅰ题为选择题,在给出的四个选项中,至少有两项是符合
题目要求的,请将符合题目要求的选项标号填在答题卡相应位置;第Ⅱ题为非选择题,
请在答题卡相应位置做答并写明小题号。



为了防治酸雨,减少煤燃烧时向大气排放的SO2,工业上通过生石灰和含硫的煤混合使用可以“固硫”(避免硫化合物进入大气),最后生成石膏。试回答:
(1)整个“固硫”反应所涉及的反应类型包括:①化合②分解③置换④复分解⑤氧化还原反应⑥非氧化还原反应⑦离子反应⑧非离子反应(分子反应)。其中正确的是
A.①⑤⑥⑦ B.①②③⑤⑧ C.①⑤⑥⑧ D.②④⑤⑦
(2) 第一步“固硫”反应的化学方程式中所需气态物质的化学计量数之和为
A.1 B. 2 C.3 D.4
(3)比较此法与“石灰石粉末与含硫煤混合”法哪个更好些?为什么?
(4)你认为减少酸雨产生可采取的措施是
①少用煤作燃料②把工厂的烟囱造高 ③先将燃料煤脱硫 ④在土壤中加石灰防止酸化 ⑤开发新能源,避免含S、N的氧化物大量排放
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com