
题目列表(包括答案和解析)
| A.常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B.在0.1mol/LNa2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32﹣)减小 |
| C.0.1mol·L﹣1NH4C1溶液与0.05mol·L﹣1 NaOH溶液等体积混合溶液中离子浓度: c(Cl﹣)>c(NH4+)>c(Na+)>c(OH﹣) |
| D.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN﹣),则a一定小于b |
下列说法正确的是:
| A.常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B.在0.1mol/LNa2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32﹣)减小 |
| C.0.1mol·L﹣1NH4C1溶液与0.05mol·L﹣1 NaOH溶液等体积混合溶液中离子浓度: c(Cl﹣)>c(NH4+)>c(Na+)>c(OH﹣) |
| D.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN﹣),则a一定小于b |
下列说法正确的是:( )
A.常温下,将pH=3的盐酸与pH=b的氨水等体积混合,混合液pH=7,则b<11
B.pH=11的Na2CO3溶液加水稀释,溶液中所有的离子浓度均降低
C.常温下醋酸分子不可能存在于pH>7的碱性溶液中
D.0.1mol/L酸HA与0.1mol/L NaOH溶液等体积混合后pH>7,则混合物中
c(Na+)=c(A-)+c(HA)=0.1mol/L
下列说法正确的是
| A.常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(NH+4)>c(Cl-) |
| C.0.lmol ·L-1的氯化铵溶液与0.05mol·L-1的氢氧化钠溶液等体积混合后溶液中离子浓度的大小关系是:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) |
| D.0.lmol ·L-1硫化钠溶液中离子浓度的关系:c(Na+)=c(S2-)+ c(HS-)+ c(H2S) |
醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。(已知:25℃,Ka(CH3COOH)=1.69×10-5)。 请回答:
⑴ 写出醋酸钠在水中发生水解反应的离子方程式: ;
⑵ 在CH3COONa溶液中离子浓度由大到小的顺序为
(用“c(Bn+)”表示相应离子浓度);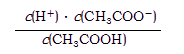
⑶ 25℃时,醋酸的电离平衡常数表达式Ka= 。0.10mol/L的醋酸溶液的pH约为 (提示:醋酸的电离常数很小,平衡时的c(CH3COOH)
可近似视为仍等于0.10mol/L; 已知:lg1.3=0.114);
⑷ 对于醋酸溶液和醋酸钠溶液的下列说法正确的是
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小。
升高温度可以促进醋酸电离,而升高温度则会抑制醋酸钠水解。
C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离。
⑸ 物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是 ;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
⑹ 常温时,有以下3种溶液,其中pH最小的是

⑺ 已知醋酸能![]() 够和小苏打溶液发生下列反应:
够和小苏打溶液发生下列反应:
CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O 。
用pH试纸在常温下分别测定![]() 0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,
0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,
则pH(CH3COONa) pH(NaHCO3)。(填:“>”、“<”或“=”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com