
题目列表(包括答案和解析)
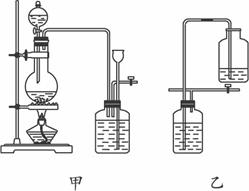
①设计甲装置的目的是_________________。甲装置__________(填“能”或“不能”)用乙装置来代替。
②装置乙中盛有的液体是__________,该装置可看作是一个___________(填某仪器名称)。
(2)在氮的化合物中,有一类盐叫亚硝酸盐,如亚硝酸钠(NaNO2)等。NaNO2是一种潜在的致癌物质,过量或长期使用会对人产生危害。由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生过被误当食盐使用的事件。已知:HNO2是一种弱酸,不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把I-氧化成I2;AgNO2是一种难溶于水易溶于酸的化合物。试回答下列问题:
①人体正常的血红蛋白中应含Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是_____________。
A.亚硝酸盐是还原剂 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被还原
②下列说法中,能用来区别NaNO2和NaCl的是______________。
A.测定这两种溶液的pH
B.用AgNO3和HNO3两种试剂来区别
C.在酸性条件下加入KI淀粉试液来区别
③把新制氯气通入到NaNO2溶液中,氯水褪色,生成NaNO3和HCl,请写出此反应的离子方程式______________。
④为了测定某样品中NaNO2的含量,可以使用标准?KMnO4?溶液进行滴定,试回答:KMnO4溶液在滴定过程中作____________(填“氧化剂”或“还原剂”),该滴定过程_____________(填“要”或“不要”)另加指示剂。
⑤已知HNO2的酸性比醋酸略强,某同学在家中进行鉴别NaNO2与NaCl的实验,但他家中只有浓醋酸,请问该实验能否成功?____________(填“能”或“不能”),请说明理由_______
_____________________________________________________________________。
(11分)有这样一个实验:在两支试管中分别加入3mL某浓度的稀盐酸(足量),将两个各装有0.3g NaHCO3和 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如右图:
(1)盛______________(填化学式)的试管中气球变得更大, 大小气球(不计气球的弹力和气体温度影响) 体积之比约为(填最简单整数比)____________。
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3粉末的试管变热。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了如下热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3-(aq)+H+(aq) →H2O(l)+ CO2(g) ΔH1; ΔH1>0
CO32-(aq)+ 2H+(aq) → H2O(l) + CO2(g) ΔH2 ; ΔH2<0
甲同学所作结论的方法是否正确?___________(填“正确”或“不正确”)。
(3)为研究该反应是吸热还是放热反应,某研究小组以《NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究》为研究课题,进行了如下实验(每次实验各做三次,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高 或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2 Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
请你帮助填写相关内容:
该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为______________和_______________;
(4)通过上述实验可以得出_____________(填字母编号)。
A、NaHCO3的溶解是吸热过程
B、NaHCO3的饱和溶液和盐酸的反应是吸热反应
C、Na2CO3的溶解是放热过程
D、Na2CO3的饱和溶液和盐酸的反应是吸热反应
(5)结论:影响NaHCO3固体与稀盐酸反应的反应热因素有________________________________________________________________________。
(11分)有这样一个实验:在两支试管中分别加入3mL某浓度的稀盐酸(足量),将两个各装有0.3g NaHCO3和 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如右图:
(1)盛______________(填化学式)的试管中气球变得更大, 大小气球(不计气球的弹力和气体温度影响) 体积之比约为(填最简单整数比)____________。
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3粉末的试管变热。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了如下热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3-(aq)+ H+(aq) →H2O(l)+ CO2(g) ΔH1;ΔH1>0
CO32-(aq)+ 2H+(aq) → H2O(l) + CO2(g) ΔH2 ;ΔH2<0
甲同学所作结论的方法是否正确?___________(填“正确”或“不正确”)。
(3)为研究该反应是吸热还是放热反应,某研究小组以《NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究》为研究课题,进行了如下实验(每次实验各做三次,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高 或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2 Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
| A.NaHCO3的溶解是吸热过程 |
| B.NaHCO3的饱和溶液和盐酸的反应是吸热反应 |
| C.Na2CO3的溶解是放热过程 |
| D.Na2CO3的饱和溶液和盐酸的反应是吸热反应 |
(11分)有这样一个实验:在两支试管中分别加入3mL某浓度的稀盐酸(足量),将两个各装有0.3g NaHCO3和 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如右图:

(1)盛______________(填化学式)的试管中气球变得更大, 大小气球(不计气球的弹力和气体温度影响) 体积之比约为(填最简单整数比)____________。
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3粉末的试管变热。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了如下热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3-(aq)+ H+(aq) →H2O(l)+ CO2(g) ΔH1 ; ΔH1>0
CO32-(aq)+ 2H+(aq) → H2O(l) + CO2(g) ΔH2 ; ΔH2<0
甲同学所作结论的方法是否正确?___________(填“正确”或“不正确”)。
(3)为研究该反应是吸热还是放热反应,某研究小组以《NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究》为研究课题,进行了如下实验(每次实验各做三次,取平均值):
|
序号 |
试剂1 |
试剂2 |
混合前温度 |
混合后最高 或最低温度 |
|
① |
35mL水 |
2.5g NaHCO3固体 |
20℃ |
18.5℃ |
|
② |
35mL水 |
3.2 Na2CO3固体 |
20℃ |
24.3℃ |
|
③ |
35mL稀盐酸 |
含2.5g NaHCO3的饱和溶液32.5mL |
20℃ |
19℃ |
|
④ |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶液23.1mL+10ml水 |
20℃ |
24.2℃ |
|
⑤ |
35mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
16.2℃ |
|
⑥ |
35mL稀盐酸 |
3.2g Na2CO3固体 |
20℃ |
25.1℃ |
请你帮助填写相关内容:
该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为______________和_______________;
(4)通过上述实验可以得出_____________(填字母编号)。
A、NaHCO3的溶解是吸热过程
B、NaHCO3的饱和溶液和盐酸的反应是吸热反应
C、Na2CO3的溶解是放热过程
D、Na2CO3的饱和溶液和盐酸的反应是吸热反应
(5)结论:影响NaHCO3固体与稀盐酸反应的反应热因素有________________________________________________________________________。
有这样一个实验:在两支试管中分别加入3mL某浓度的稀盐酸(足量),将两个各装有0.3g NaHCO3和 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如右图:
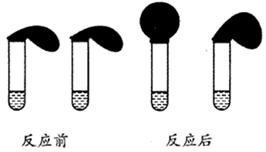
(1)盛______________(填化学式)的试管中气球变得更大, 大小气球(不计气球的弹力和气体温度影响) 体积之比约为(填最简单整数比)____________。
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3粉末的试管变热。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了如下热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3-(aq)+ H+(aq) →H2O(l)+ CO2(g) ΔH1 ; ΔH1>0
CO32-(aq)+ 2H+(aq) → H2O(l) + CO2(g) ΔH2 ; ΔH2<0
甲同学所作结论的方法是否正确?___________(填“正确”或“不正确”)。
(3)为研究该反应是吸热还是放热反应,某研究小组以《NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究》为研究课题,进行了如下实验(每次实验各做三次,取平均值):
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高 或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2 Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
请你帮助填写相关内容:
该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为______________和_______________;
(4)通过上述实验可以得出_____________(填字母编号)。
A、NaHCO3的溶解是吸热过程
B、NaHCO3的饱和溶液和盐酸的反应是吸热反应
C、Na2CO3的溶解是放热过程
D、Na2CO3的饱和溶液和盐酸的反应是吸热反应
(5)结论:影响NaHCO3固体与稀盐酸反应的反应热因素有________________________________________________________________________。
选择题
一、选择题(本题包括13小题,每小题只有一个选项是正确的。每小题6分,共78分)
1―5CBDAA 6―10ADDBC 11―13BCD
二、选择题(本题包括8小题,共48分。每小题给出的四个选项中,有的只有一个选项正确有的有多个选项正确,全部选对的得6分,选对但不全得3分,有选错的得0分)
14.C 15.ACD 16.B 17.A 18.C 19.D 20.AD 21.B
非选择题
22.(18分)
(I)(1)透过玻璃砖调整视线让P2的像挡住P1的像,在该视线方向竖直插上,P3,使其挡住P2和P1的像。(只要答出P3挡住P2和P1的像即给分)(3分)
|