
题目列表(包括答案和解析)
(7分)根据下图回答问题:

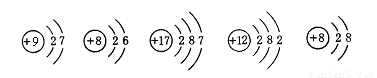

(1)下列从图A中获得的信息不正确的是 。
①该元素的原子序数为28.09 ②该元素符号为Si
③该元素属于非金属元素 ④由该元素组成的单质常温下为固体
(2)从B ~ F的微粒示意图中可以看出,元素的化学性质相似的是(填序号) ,
属于同种元素的是(填序号) ,属于阴离子的是(填序号) 。
(3)E表示的微粒在化学反应中容易(填“得”或“失”) 电子,在化合物中该元素通常为 价。该元素组成的单质在氧气中燃烧的化学方程式为______________。
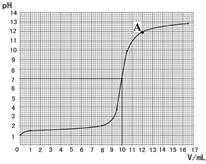 (2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为
(2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为| 加入氢氧化钠 的体积/mL | 0 | 1.0 | 8.0 | 9.5 | 10.5 | 12.0 | 16.5 |
| 烧杯中溶液pH | 1.0 | 1.3 | 2.0 | 3.9 | 9.9 | 11.9 | 12.8 |
(7分)下图为元素周期表的一部分,请认真阅读后,回答下列问题:
|
|
IA |
|
|
|
|
|
|
0 |
||
|
1 |
1 H 氢 1.008 |
|
|
|
|
|
|
2 He 氦 4.003 |
||
|
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|||||
|
2 |
3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
||
|
3 |
11 Na 钠 22.99 |
12 Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.96 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
(1)第3周期(横行)的金属元素有______________种
(2)原子序数为8的元素是_____________,它位于元素周期表中的第___________周期,第_______族;原子序数为16的硫元素的相对原子质量是_________________。
(3)通过归纳,金属元素名称一般有“金”字旁;固态非金属元素名称有“石”字旁;气态非金属元素名称有“气”字头。则硅元素属于__________________元素;氟元素属于______元素。(选填序号)
①金属 ②固态非金属 ③气态非金属
(7分)实验室需配制4%的氢氧化钠溶液200g,并用此溶液测定某敞口放置一段时间的盐酸的溶质质量分数。
(1)配制200g质量分数为4%的氢氧化钠溶液,需要氢氧化钠固体的质量为 g,水的体积为 mL(水的密度近似看作1g/cm3)。 (2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为
(2)取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为
4%的氢氧化钠溶液,用pH计(一种测定溶液pH的仪器)
测定溶液的pH,得到的数据如下:
| 加入氢氧化钠 的体积/mL | 0 | 1.0 | 8.0 | 9.5 | 10.5 | 12.0 | 16.5 |
| 烧杯中溶液pH | 1.0 | 1.3 | 2.0 | 3.9 | 9.9 | 11.9 | 12.8 |
(7分)根据下图回答问题:



(1)下列从图A中获得的信息不正确的是 。
①该元素的原子序数为28.09 ②该元素符号为Si
③该元素属于非金属元素 ④由该元素组成的单质常温下为固体
(2)从B ~ F的微粒示意图中可以看出,元素的化学性质相似的是(填序号) ,
属于同种元素的是(填序号) ,属于阴离子的是(填序号) 。
(3)E表示的微粒在化学反应中容易(填“得”或“失”) 电子,在化合物中该元素通常为 价。该元素组成的单质在氧气中燃烧的化学方程式为______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com