
题目列表(包括答案和解析)
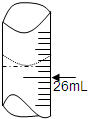 为了测出某氢氧化钠溶液的物质的量浓度,某研究性学习小组先用广泛pH试纸测出该溶液的pH,发现该溶液的pH=14.于是他们用碱式滴定管量取25.00mL待测氢氧化钠溶液盛放在锥形瓶中,把0.1000mol/L的标准盐酸溶液注入50mL的酸式滴定管中,然后进行中和滴定操作.
为了测出某氢氧化钠溶液的物质的量浓度,某研究性学习小组先用广泛pH试纸测出该溶液的pH,发现该溶液的pH=14.于是他们用碱式滴定管量取25.00mL待测氢氧化钠溶液盛放在锥形瓶中,把0.1000mol/L的标准盐酸溶液注入50mL的酸式滴定管中,然后进行中和滴定操作. 在25mL氢氧化钠溶液中逐滴加入0.2mol?L-1醋酸溶液,滴定曲线如图所示.
在25mL氢氧化钠溶液中逐滴加入0.2mol?L-1醋酸溶液,滴定曲线如图所示.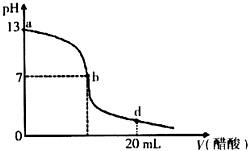 向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示,下列说法不正确的是( )
向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示,下列说法不正确的是( )(1)在100 g水中溶解多少克NaOH才能制得a%的溶液?
(2)该NaOH溶液的物质的量浓度是多少?
(3)在1 mL上述溶液中含有Na+多少摩尔?
已知某氢氧化钠溶液的质量分数为a%,密度为ρ g·mL-1,求:
(1)在100 g水中溶解多少克NaOH才能制得a%的溶液?
(2)该NaOH溶液的物质的量浓度是多少?
(3)在1 mL上述溶液中含有Na+多少摩尔?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com