
题目列表(包括答案和解析)
| A、实验室稀释浓硫酸时,应将浓硫酸沿烧杯内壁慢慢注入到水中,并用玻璃棒不断搅拌 | B、实验室称量氢氧化钠固体时,放在纸片上称量 | C、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 | D、含硫酸的废液倒入水槽中,再用水冲入下水道 |
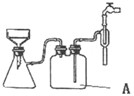 亚铁盐在空气中易被氧化,但形成复盐可稳定存在.硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,商品名为摩尔盐,易溶于水,不溶于乙醇. 通常可用如下步骤在实验室中少量制备:
亚铁盐在空气中易被氧化,但形成复盐可稳定存在.硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,商品名为摩尔盐,易溶于水,不溶于乙醇. 通常可用如下步骤在实验室中少量制备:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com