
题目列表(包括答案和解析)
认识反应规律,控制反应条件,让化学反应为人类服务.
(1)化学小组的同学利用图12所示的装置探究燃烧的条件.

①通过对比铜片上红磷和白磷的不同现象,得出的结论是 .
②小明同学对以上实验进行概括,得出的下列说法中,不正确的是 (填字母序号).
A.此组实验烧杯中的热水只起提高温度的作用
B.图1中水下白磷未燃烧是由于没有与氧气接触
C.对图1实验应该进行三组对比分析
D.若将图2中白磷换成红磷,不能观察到燃烧现象
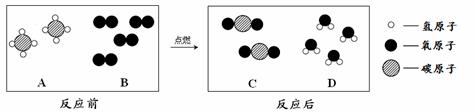
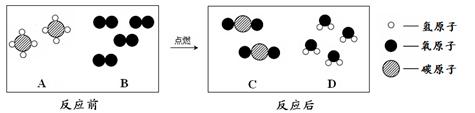
(2)A常用于切割金属.在点燃条件下,A和B反应能生成C和D.反应前后分子变化的微观示意图如图3所示.
①下列说法正确的是 (填字母序号).
A.该反应属于放热反应 B.A物质具有可燃性
C.化学反应前后原子的种类不变 D.该反应属于置换反应
②该反应中A与B的质量比是 .
③该反应过程中,若提高B物质的浓度及用量,好处是 .

化学中质量守恒定律是一个非常重要的定量定律。
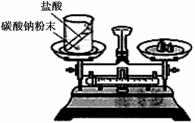
(1)如右图装置中,称量小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生一段时间后,再称量小烧杯及烧瓶内物质的总质量为 m2,则(填“=” “>”“<”)m1 m2 ,其原因为 。
(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃
料。燃烧反应前后分子种类变化的微观示意图如下所示。
①1个B分子中含有 个原子。
②四种物质中属于化合物的是 (填图中字母)。
(3)A和B可发生如下反应:3A+2B=A3B2,某学生做了3次该实验(每次均充分反应),反应前A和B的质量![]() 和都是l0g。有关实验数据见下表:
和都是l0g。有关实验数据见下表:
| 序号 | 反应前A的质量 | 反应前B的质量 | 反应后A3B2的质量 |
| ① | 8g | 2g | 6g |
| ② | 4g | 6g | 6g |
| ③ | xg | yg | 9g |
X∶Y的比值可能为 或 。
(4)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如
下:
【提出问题】样品中碳酸钠的质量分数是多少?
【知识准备】食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发。
【设计方案】(1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
【进行实验】甲组同学:称取24.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水。过滤、洗涤、干燥,共得到白色沉淀20.00g。
乙组同学:称取24.00g样品,加入足量的稀盐酸直到反应停止,共收集到8.80g二氧化碳。
【解决问题】请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数。(写出计算过程。计算结果精确到0.1% )
 化学中质量守恒定律是一个非常重要的定量定律。
化学中质量守恒定律是一个非常重要的定量定律。
(1)如右图装置中,称量小烧杯中所有物质的质量m1,然
后将小烧杯中的碳酸钠与盐酸完全混合,反应发生一
段时间后,再称量小烧杯及烧瓶内物质的总质量为
m2,则(填“=” “>”“<”)m1 m2 ,其原
因为 。
(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃
料。燃烧反应前后分子种类变化的微观示意图如下所示。
①1个B分子中含有 个原子。
②四种物质中属于化合物的是 (填图中字母)。
(3)A和B可发生如下反应:3A+2B=A3B2,某学生做了3次该实验(每次均充分反应),反应前A和B的质量 和都是l0g。有关实验数据见下表:
序号 反应前A的质量 反应前B的质量 反应后A3B2的质量
① 8g 2g 6g
② 4g 6g 6g
③ xg yg 9g
X∶Y的比值可能为 或 。
(4)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
【提出问题】样品中碳酸钠的质量分数是多少?
【知识准备】食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发。
【设计方案】(1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
【进行实验】甲组同学:称取24.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水。过滤、洗涤、干燥,共得到白色沉淀20.00g。
乙组同学:称取24.00g样品,加入足量的稀盐酸直到反应停止,共收集到8.80g二氧化碳。
【解决问题】请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数。(写出计算过程。计算结果精确到0.1% )
化学中质量守恒定律是一个非常重要的定量定律。
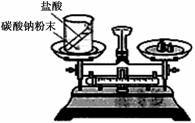
(1)如下图装置中,称量小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生一段时间后,再称量小烧杯及烧瓶内物质的总质量为 m2,则(填“=” “>”“<”)m1 m2 ,其原因为 。

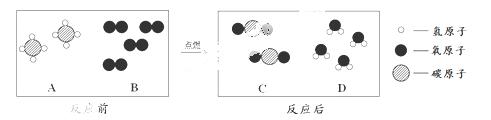
(2)天然气的主要成分是甲烷(CH4),可直接用作气体燃料。燃烧反应前后分子种类变化的微观示意图如下所示。
①1个B分子中含有 个原子。
②四种物质中属于化合物的是 (填图中字母)。
(3)A和B可发生如下反应:3A+2B=A3B2,某学生做了3次该实验(每次均充分反应),反应前A和B的质量 和都是l0g。有关实验数据见下表:
序号 反应前A的质量 反应前B的质量 反应后A3B2的质量
① 8g 2g 6g
② 4g 6g 6g
③ xg yg 9g
X∶Y的比值可能为 或 。
(4)为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
《提出问题》样品中碳酸钠的质量分数是多少?
《知识准备》食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发。
《设计方案》(1)方案一:向一定量样品中加入过量澄清石灰水,根据反应生成碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
(2)方案二:向一定量样品中加入足量的稀盐酸,根据反应生成二氧化碳的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
《进行实验》甲组同学:称取24.00g样品,加水配成溶液,在溶液中加入过量的澄清石灰水。过滤、洗涤、干燥,共得到白色沉淀20.00g。
乙组同学:称取24.00g样品,加入足量的稀盐酸直到反应停止,共收集到8.80g二氧化碳。
《解决问题》请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量分数。(写出计算过程。计算结果精确到0.1% )
一、选择题(每题2分,共30分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
答案
C
B
D
A
D
A
C
D
B
D
B
A
B
A
C
二、填空与简答(每个化学方程式2分,其余每空1分,共40分)
16、(1)+5(2)吸附(3)CH3COOH(4)CH4(5)减少用量,减轻白色污染
17、①牛奶;②维生素;蔬菜、水果 18、(1)①(2)⑤(3)③(4)⑥
19、(1)导电、导热、延展性(2)②④(3)H2+CuO Cu+H2O(合理均可)(4)保持铁器表面干燥、洁净(合理均可)(5)①③④⑤ 20、(1)A(2)b;加水(3)否;t℃时,a、b两物质的溶解度不相等 21、(1)O2;食物(2)工程塑料(3)2LiOH+CO2=Li2CO3+H2O 22、(1)1:3(2)a:3:(
Cu+H2O(合理均可)(4)保持铁器表面干燥、洁净(合理均可)(5)①③④⑤ 20、(1)A(2)b;加水(3)否;t℃时,a、b两物质的溶解度不相等 21、(1)O2;食物(2)工程塑料(3)2LiOH+CO2=Li2CO3+H2O 22、(1)1:3(2)a:3:(
24、①CuSO4;有硫酸铜则溶液呈蓝色 ②MgCl2、NaCl (合理均可) ③降低水的凝固点
三、综合题(30小题6分,每个化学方程式2分,其余每空1分,共30分)
25、(1)微溶于水的无色气体(2)NH3 (3)2NO+2CO 2CO2+N2
2CO2+N2
26、(1)酒精灯;2KMnO4 K2MnO4+MnO2+O2↑;先将导管从水漕中取出(2)A;①(3)反应条件与反应物状态27、(1)①粗盐提纯②检查装置的气密性(2)将干燥小花直接放入氨气中;证明氨气不会使红色石蕊试纸变蓝色
K2MnO4+MnO2+O2↑;先将导管从水漕中取出(2)A;①(3)反应条件与反应物状态27、(1)①粗盐提纯②检查装置的气密性(2)将干燥小花直接放入氨气中;证明氨气不会使红色石蕊试纸变蓝色
28、(1)取水样分别放入两支试管中,各滴入少量肥皂水振荡;泡沫多的是纯水,泡沫少的是硬水;(2)①将气体通入澄清石灰水,澄清石灰水变浑浊 ②CaCO3+2HCl=CaCl2+H2O+CO2↑ (3)①加热煮沸; 热水瓶中结水垢降低保温性能;②加入食醋浸泡
29、(1)塑料瓶变扁;将二氧化硫水溶液滴到pH试纸上,与标准比色卡比较颜色
(2)否;因为二氧化硫溶解或与水反应均可有此现象
30、(1)解:设需这种浓硫酸的质量为x
X=
(2)设可制得氢气的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 2
65:2=6.5:y
y=
答:需这种浓硫酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com