
题目列表(包括答案和解析)
(07年高考海南化学卷?13) 下表为元素周期表的一部分,请回答有关问题:
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(1)⑤和⑧的元素符号是______和_______;
(2)表中最活泼的金属是______,非金属性最强的元素是______;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是_______,分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的化学方程式:___________________________________,__________________________________________;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:____________________________
_______________________________________________。
(07年高考海南化学卷?2)下列原子序数所对应的元素组中,两者可形成离子键的是
A.1和17 B.12和9 C.14和6 D.15和8
(07年高考海南化学卷?22)下列叙述正确的是
A.分子晶体中的每个分子内一定含有共价键
B.原子晶体中的相邻原子间只存在非极性共价键
C.离子晶体中可能含有共价键
D.金属晶体的熔点和沸点都很高
下列两种气体的分子数一定相等的是( )
A.质量相等、密度不等的N2和C2H4 B.等体积、等密度的CO和C2H4
C.等温、等体积的O2和N2 D.等压、等体积的N2和CO2
这道题源于人民教育出版社化学教材第一册53页第二大题第5题,原题如下:
在相同条件下,下列气体中所含分子数目最多的是( )
A.1 g H2 B.10 g O2 C.30 g Cl2 D.17 g NH3
上述两题均为比较数目分子的。课本题目重点考查基本公式:N=nNA,n=m/M。高考题在本题基础上进行了拓展,重点考查阿伏加德罗定律及其推论。不论怎样考查,大家记住气体物质的量的大小决定分子数的多少即可。
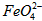 与水反应的化学方程式:
与水反应的化学方程式: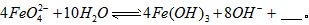
 在处理水的过程中所起的作用是____________和_____________。
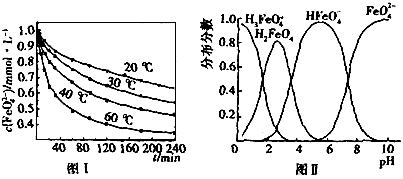
在处理水的过程中所起的作用是____________和_____________。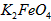 配制成c(
配制成c(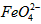 )=1.0mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(
)=1.0mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(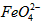 )的变化,结果见图I。第(1)题中的反应为
)的变化,结果见图I。第(1)题中的反应为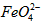 的变化的主反应,则温度对该反应的反应速率和平衡移动的影响是__________________;发生反应的△H_________0(填“﹥”、“﹤”或“=”)。
的变化的主反应,则温度对该反应的反应速率和平衡移动的影响是__________________;发生反应的△H_________0(填“﹥”、“﹤”或“=”)。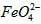 在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是________(填字母)。
在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是________(填字母)。 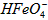 的分布分数先增大后减小
的分布分数先增大后减小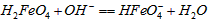
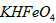 稀溶液加入水的过程中,pH可能增大也可能减小
稀溶液加入水的过程中,pH可能增大也可能减小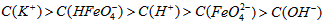
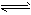 Fe3+(aq)+3OH-(aq),已知25℃时,溶度积常数
Fe3+(aq)+3OH-(aq),已知25℃时,溶度积常数湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com