
题目列表(包括答案和解析)
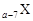 、
、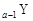 、
、 、
、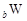 、
、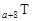 是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
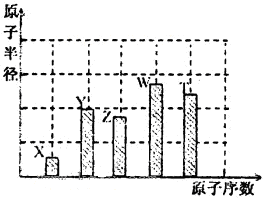
(l)W在周期表中的位置为_______________________。
(2)Y、Z的10电子氢化物分子中均含有的化学键类型为___________;其稳定性较强的是___________
(填化学式)。
(3)用化学方程式表示YZ2形成酸雨的反应:______________________。
用精密pH试纸(精确到0.l)测定酸雨pH的操作是______________________。
(4)常温下用1 mol/L100 mL NaOH溶液恰好完全吸收0.1molTZ2气体,此反应的离子方程式为
______________________;此时溶液pH<7的原因是___________________________。
(5)在25℃、101kPa下,己知W与X形成的气态化合物与足量Z2点燃完全反应(生成W的最高价
化合物),恢复至原状态,平均每转移l mol e_放热190 kJ,该反应的热化学方程式为___________。
 、
、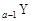 、
、 、
、 、
、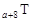 是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
是五种常见的短周期元素,其原子半径随原子序数变化如下图所示。Z是地壳中含量最高的元素。W原子最外层电子数是K层电子数的2倍。
(l)W在周期表中的位置为_______________________。
(2)Y、Z的10电子氢化物分子中均含有的化学键类型为___________;其稳定性较强的是___________
(填化学式)。
(3)用化学方程式表示YZ2形成酸雨的反应:______________________。
用精密pH试纸(精确到0.l)测定酸雨pH的操作是______________________。
(4)常温下用1 mol/L100 mL NaOH溶液恰好完全吸收0.1molTZ2气体,此反应的离子方程式为
______________________;此时溶液pH<7的原因是___________________________。
(5)在25℃、101kPa下,己知W与X形成的气态化合物与足量Z2点燃完全反应(生成W的最高价
化合物),恢复至原状态,平均每转移l mol e_放热190 kJ,该反应的热化学方程式为___________。

已知:A、B、D为中学化学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol丁分子中不同原子的数目比为1∶2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如下图所示(某些条件已略去).

请回答:
(1)单质A的组成元素在周期表中的位置是________.
(2)乙中所包含的化学键类型有________(填字母序号).
a.离子键
b.极性共价键
c.非极性共价键
(3)用电子式表示丙分子的形成过程________.
(4)反应①的化学方程式为________.
(5)丁的电子式为________.
(6)反应②中,0.5 mol NaClO参加反应时,转移1 mol电子,其离子方程式为:________.
(7)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为________.
四种短周期元素A、B、C、D的原子序数依次递增.其中A、B、C三种元素基态原子的2p能级上都有未成对电子.且未成对电子个数分别是2、3、2;D与C 可以形成D2C和D2C2两种化合物。回答下列问题:
(1)已知A元素与氢元素形成的某种气态化合物在标准状况下的密度为1.161g/L,则在该化合物的分子中A原子的杂化方式为???? 。
(2)A、B、C二种元素的第一电离能由小到大的顺序为?????? (填元素符号)。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5……,推测D元素的电离能第一次突增应出现在第___电离能。
(4)AC2在高温高压下所形成的晶体其晶胞如图所示。该晶体的类型属于______________晶体.该晶体中A原子轨道的杂化类型为??????? 。
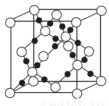
(5)C和C形成原子个数比为1:3的常见离子.推测这两种微粒的空间构型为???????????? 。
(6)C和D形成的一种离子化合物D2C的晶胞结构如图所示.该晶体中阳离子的配位数为?????? 。距一个阴离子周围最近的所有阳离子为顶点构成的几何体为????????? 。

已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA.则晶胞边长a=?? cm(用含ρ、NA的代数式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com