
题目列表(包括答案和解析)
| 探究内容 | 实验方案 | 实验现象 | 写出下列离子方程式 |
| 探究Fe2+具有还原性 | 取少量0.1mol?L-1FeCl溶液,加入少量KSCN溶液后,再往溶液中加入少量 新制氯水 新制氯水 |
溶液先不变红,后变为血红色 | ①Fe2+发生的反应: 2Fe2++Cl2=2Fe3++2Cl- 2Fe2++Cl2=2Fe3++2Cl- |
| 探究Fe3+具有氧化性 | 取少量0.1mol?L-1FeCl溶液,加入足量 铁粉 铁粉 后,再往溶液中加入少量KSCN溶液 |
溶液不变为血红色 | Fe3+发生的反应: 2Fe3++Fe=3Fe2+ 2Fe3++Fe=3Fe2+ |
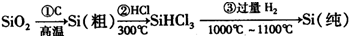
| ||
| ||


 依据氧化还原反应:Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)设计的原电池如图所示.
依据氧化还原反应:Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)设计的原电池如图所示.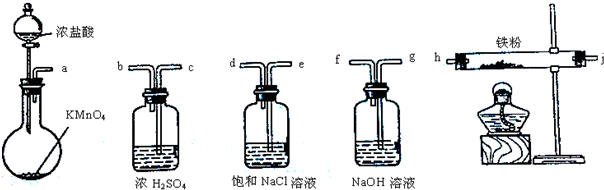
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | 溶液变红色 溶液变红色 |
固体物质中含有FeCl3 |
| 分别向KMnO4溶液中加入适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 FeCl2 FeCl2 |
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com