(2013?青岛一模)(Ⅰ)铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是
防止铁盐、铜盐发生水解反应
防止铁盐、铜盐发生水解反应
;
(2)检验溶液B中是否存在Fe
3+的方法是
取少量溶液B,滴加几滴KSCN溶液,若无明显现象则溶液中无Fe3+,若溶液变红色,则存在Fe3+
取少量溶液B,滴加几滴KSCN溶液,若无明显现象则溶液中无Fe3+,若溶液变红色,则存在Fe3+
;
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO
4溶液中加入一定量的Na
2SO
3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是
2Cu
2++SO
32-+2Cl
-+H
2O
2CuCl↓+SO
42-+2H
+2Cu
2++SO
32-+2Cl
-+H
2O
2CuCl↓+SO
42-+2H
+;
(Ⅱ)(1)常温下,某同学将稀盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
| 实验编号 |
氨水物质的量浓度
(mol?L-1) |
盐酸物质的量浓度
(mol?L-1) |
混合溶液pH |
| ① |
0.1 |
0.1 |
pH=5 |
| ② |
C |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH>7 |
请回答:从第①组情况分析,该组所得混合溶液中由水电离出的c(H
+)=
1×10-5 mol?L-1
1×10-5 mol?L-1
mol?L
-1;从第②组情况表明,C
>
>
0.2mol?L
-1(选填“>”、“<”或“=”);
从第③组情况分析可知,混合溶液中c(NH
4+)
>
>
c(NH
3?H
2O)(选填“>”、“<”或“=”).
(2)写出以下四组溶液NH
4+离子浓度由大到小的顺序
B
B
>
D
D
>
A
A
>
C
C
(填选项编号).
A.0.1mol?L
-1 NH
4Cl B.0.1mol?L
-1 NH
4Cl和0.1mol?L
-1 NH
3?H
2O
C.0.1mol?L
-1 NH
3?H
2O D.0.1mol?L
-1NH
4Cl和0.1mol?L
-1 HCl.

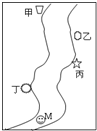 如图所示,在一条鱼、虾几乎绝迹的小河边,从上游到下游依次有甲、乙、丙、丁四座工厂,各厂排放的废水里都只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍澄清.请回答:
如图所示,在一条鱼、虾几乎绝迹的小河边,从上游到下游依次有甲、乙、丙、丁四座工厂,各厂排放的废水里都只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍澄清.请回答: (2011?惠州模拟)铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛.
(2011?惠州模拟)铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛.