
题目列表(包括答案和解析)
(09全国卷2,27)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据表中数据,在图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 1.00 | 0.00 |
1 | 0.90 | 0.80 | 0.20 |
3 | 0.75 | 0.50 | 0.50 |
5 | 0.65 | 0.30 | 0.70 |
9 | 0.55 | 0.10 | 0.90 |
10 | 0.55 | 0.10 | 0.90 |
14 | 0.55 | 0.10 | 0.90 |
(2) 体系中发生反应的化学方程式是___________________________;
(3) 列式计算该反应在0-3min时间内产物Z的平均反应速率:_______________;
(4) 该反应达到平衡时反应物X的转化率![]() 等于___________________________;
等于___________________________;
(5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:
① _________________ ②________________ ③__________________
(2008年北京卷,理综,27)(3)用图示装置制备NO并验证其还原性。有下列主要操作:
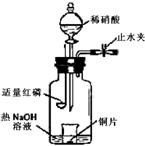 a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是___________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是 ____________________________________________________________________。
③步骤c滴入稀硝酸后烧杯中的现象是_____________________________________
______________________________________________________________________。反应的离子方程式是____________________________________________________。
(06年北京卷)下列叙述不正确的是( )
A. 用酒精清洗沾到皮肤上的苯酚
B. 用氨水清洗试管壁附着的银镜
C. 用盐析的方法分离油脂皂化反应的产物
D. 用冷凝的方法从氨气、氮气和氢气混合气中分离出氨
(09广东卷).(分) 甲酸甲酯水解反应方程式为:
HCOOCH3(l)+H2O(l)![]() HCOOH(l)+CH3OH(l);△H>0
HCOOH(l)+CH3OH(l);△H>0
某小组通过试验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:

(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
| 反应时间范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均反应速率/(10-3mol·min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
请计算15-20min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率为 mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因: 。
(3)上述反应的平衡常数表达式为:![]() ,则该反应在温度T1下的K值为 。
,则该反应在温度T1下的K值为 。
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
(08年北京卷)下列叙述正确的是( )
A.金属与盐溶液的反应都是置换反应
B.阴离子都只有还原性
C.与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物
D.分子晶体中都存在范德瓦耳斯力,可能不存在共价键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com