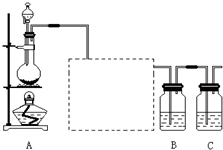
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)装置A的分液漏斗中盛装的试剂是
浓盐酸
浓盐酸
,烧瓶中加入的试剂是
MnO2
MnO2
.
(2)画出虚线框内的实验装置图,并注明所加试剂,
说明装置的作用
除去Cl2中的HCl气体
除去Cl2中的HCl气体
.
(3)装置B中盛放的试剂是
A
A
(选填下列所给试剂的代码),实验现象为
有淡黄色沉淀生成
有淡黄色沉淀生成
,化学反应方程式是
Na2S+Cl2=2NaCl+S↓
Na2S+Cl2=2NaCl+S↓
,该反应属于四种基本反应类型中的
置换
置换
反应.
A.Na
2S溶液 B.Na
2SO
3溶液 C.Na
2SO
4溶液
(4)从原子结构的角度简要分析氯元素的非金属性比硫元素的非金属性强的原因.
Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强.
Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强.
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例).
HCl的稳定性比H2S的稳定性强或者HClO4的酸性比H2SO4的酸性强.(其他合理答案均可)
HCl的稳定性比H2S的稳定性强或者HClO4的酸性比H2SO4的酸性强.(其他合理答案均可)
(6)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气.在该反应中,Cl元素的化合价既有升高又有降低,即在反应中Cl元素的原子既能获得电子也能失去电子,能否说氯元素既具有金属性又具有非金属性?简述你的理由.
不能
不能
金属性强弱的判断以元素的单质与水(或酸)反应置换氢的难易程度,以及它的最高价氧化物的水化物的碱性强弱为依据.非金属性的强弱以它与氢气生成氢化物的稳定性或它的最高价氧化物的水化物的酸性强弱来判断.(其他合理答案均可)
金属性强弱的判断以元素的单质与水(或酸)反应置换氢的难易程度,以及它的最高价氧化物的水化物的碱性强弱为依据.非金属性的强弱以它与氢气生成氢化物的稳定性或它的最高价氧化物的水化物的酸性强弱来判断.(其他合理答案均可)
.

 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

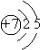
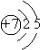
 AlO2-+H++H2O
AlO2-+H++H2O AlO2-+H++H2O
AlO2-+H++H2O