
题目列表(包括答案和解析)


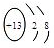
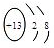
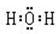
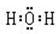
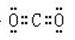
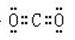

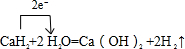
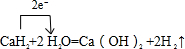
(1)A—E的元素符号为___________、___________、___________、___________、___________。
(2)C位于元素周期表中第___________周期、第___________族,其阳离子的结构示意图为___________。
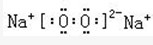
(3)D原子的电子式为___________;E离子的符号为___________。
(4)A元素与其余4种元素形成化合物的化学式为(仅限于由2种元素组成) ___________、___________、___________、___________。
(5)C单质和B单质在加热条件下生成A2B2反应的化学方程式为______________________;
反应中___________为氧化剂,___________为还原剂。
(6)
(1)A—E的元素符号为___________、___________、___________、___________、___________。
(2)C位于元素周期表中第___________周期、第___________族,其阳离子的结构示意图为___________。
(3)D原子的电子式为___________;E离子的符号为___________。
(4)A元素与其余4种元素形成化合物的化学式为(仅限于由2种元素组成) ___________、___________、___________、___________。
(5)C单质和B单质在加热条件下生成A2B2反应的化学方程式为______________________;
反应中___________为氧化剂,___________为还原剂。
(6)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com