
题目列表(包括答案和解析)
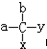 中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子.下列分子中指定的碳原子(用*标记)不属于手性碳原子的是( )
中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子.下列分子中指定的碳原子(用*标记)不属于手性碳原子的是( )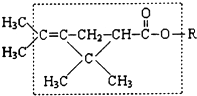 (2010?安徽模拟)大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )
(2010?安徽模拟)大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
| Fe2+ | 7.6 | 9.7 | |
| Fe3+ | 2.7 | 3.7 | |
| Al3+ | 3.8 | 4.7 | >8.5 |
| Mn2+ | 8.3 | 9.8 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com