
题目列表(包括答案和解析)
中央电视台从2001年6月5日起每天都要报道47个重点城市的空气质量预报。包括SO2和可吸入颗粒的含量。目前测定空气中SO2含量主要用氧化还原反应法。假如给你气体流速管(单位时间内通过气体的体积恒定但无除尘和吸收气体的作用)“¤”、密闭容器“□”、敞口仪器“∪”、导管“-或 、0.0001mol?L-1的酸性高锰酸钾溶液、颗粒吸附剂、品红试液、pH试纸等仪器和药品,请设计一个实验装置,测定你所在地区空气中SO2和可吸入颗粒的含量。已知5SO2+2H2O+2MnO4-(紫色)=5SO42-+2Mn2+(无色)+4H+。环境空气质量标准如下:
、0.0001mol?L-1的酸性高锰酸钾溶液、颗粒吸附剂、品红试液、pH试纸等仪器和药品,请设计一个实验装置,测定你所在地区空气中SO2和可吸入颗粒的含量。已知5SO2+2H2O+2MnO4-(紫色)=5SO42-+2Mn2+(无色)+4H+。环境空气质量标准如下: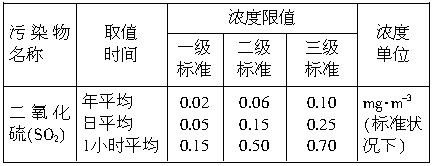
(1)画出测定空气中SO2和可吸入颗粒的含量的实验装置图(并指出仪器中的药品)。
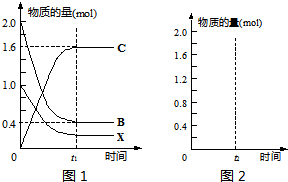
(2)若气体流速管中气体流速为5000cm3?min-1,当140min时20mL0.0001mol?L-1的酸性高锰酸钾溶液恰好退色,则根据我国空气质量标准和测定结果判断所测定地点的空气中SO2的含量属于_________(填数字)级标准(环境)。
(3)若要测定空气中可吸入颗粒的含量,需要测出的数据有__________________________________。
中央电视台自2001年6月5日起,每晚都要预报47个环境保护重点城市的空气质量,它一般将这些城市空气中的 和可吸入颗粒的含量(用
和可吸入颗粒的含量(用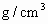 表示)分为8个等级.目前,测定空气中
表示)分为8个等级.目前,测定空气中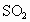 含量主要用氧化还原反应.
含量主要用氧化还原反应.
假如给你一个气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用).请设计一个实验装置,测定你所在地区的空气中 和可吸入颗粒的含量.已知:
和可吸入颗粒的含量.已知: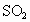 气体和酸性溶液
气体和酸性溶液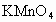 溶液反应的离子方程式为:
溶液反应的离子方程式为:
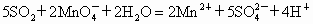
现有药品: 的酸性
的酸性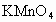 溶液、颗粒吸附剂、品红试剂、pH试纸.现有仪器:密闭容器用
溶液、颗粒吸附剂、品红试剂、pH试纸.现有仪器:密闭容器用 表示,敞口仪器用
表示,敞口仪器用 表示,导管用
表示,导管用 或
或 表示,气体流速管用
表示,气体流速管用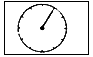 表示.
表示.
(1)配制200mL 酸性
酸性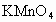 溶液,需用仪器有玻璃棒、__________、____________、____________、_____________等.玻璃棒的作用是_______________________、_____________________________.
溶液,需用仪器有玻璃棒、__________、____________、____________、_____________等.玻璃棒的作用是_______________________、_____________________________.
(2)画出测定空气中 和可吸入颗粒含量的实验装置图(并指出仪器中的药品).
和可吸入颗粒含量的实验装置图(并指出仪器中的药品).
(3)若气体流速管中气体流速为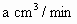 ,当tmin时200mL
,当tmin时200mL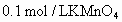 溶液恰好褪色.求空气中
溶液恰好褪色.求空气中 的含量(
的含量( ).
).
(4)若要测定空气中可吸入颗粒的含量,需要测出的数据有_____________________________________________________________.
| ||
| ||

| ||
| △ |
| ||
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |

| MgO | Al2O3 | MgCl2 | AlCl3 | |
| 熔点/℃ | 2852 | 2072 | 714 | 190(2.5×105Pa) |
| 沸点/℃ | 3600 | 2980 | 1412 | 182.7 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com