
题目列表(包括答案和解析)
(18分)工业生产的纯碱中常含有少量NaCl杂质。为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
【方案二】用0.100mol/L盐酸滴定。
【方案三】用稀酸将CO32-转化为CO2,测定CO2的质量。
解答1-4小题:
1.方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作。称量时所需定量实验仪器为____________________。判断是否达到恒重的标准是_____________________________________________________。
2.方案二的具体过程为:
①操作1所需要的仪器有_____________________________________________。
②滴定时选择的指示剂为甲基橙。当溶液____________________________________时,说明达到了滴定终点。
③为减少偶然误差,通常的处理办法是_______________________________。
④滴定时若锥形瓶内有少量液体溅出,则测定结果_________。(选填“偏高”、“偏低”、“不影响”,下同),若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,测定结果_________。
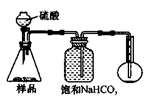
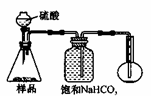
3.方案三的实验装置如下图:
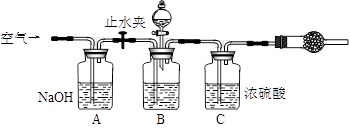
操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥ 打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g。
该方案样品中纯碱的质量分数为__________________________(用代数式表示)。
上图中装置A的作用是_____________________。装置C的作用是_____________________。有同学认为空气中的水蒸气会进入干燥管导致测量结果_____________(填“偏大”、“偏小”或“无影响”)。改进措施可以是______________________________________________。
4.若用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量。则下列装置中,最合理的是______。(选填序号)
A B
C D
(18分)工业生产的纯碱中常含有少量NaCl杂质。为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
【方案二】用0.100 mol/L盐酸滴定。
【方案三】用稀酸将CO32-转化为CO2,测定CO2的质量。
解答1-4小题:
1.方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作。称量时所需定量实验仪器为____________________。判断是否达到恒重的标准是_____________________________________________________。
2.方案二的具体过程为: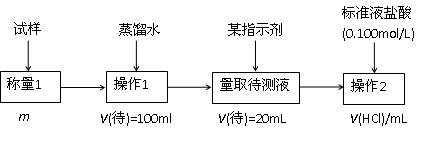
①操作1所需要的仪器有_____________________________________________。
②滴定时选择的指示剂为甲基橙。当溶液____________________________________时,说明达到了滴定终点。
③为减少偶然误差,通常的处理办法是_______________________________。
④滴定时若锥形瓶内有少量液体溅出,则测定结果_________。(选填“偏高”、“偏低”、“不影响”,下同),若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,测定结果_________。
3.方案三的实验装置如下图: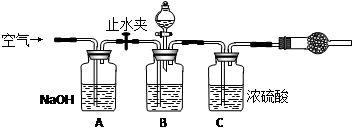
操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥ 打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g。
该方案样品中纯碱的质量分数为__________________________(用代数式表示)。
上图中装置A的作用是_____________________。装置C的作用是_____________________。有同学认为空气中的水蒸气会进入干燥管导致测量结果_____________(填“偏大”、“偏小”或“无影响”)。改进措施可以是______________________________________________。
4.若用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量。则下列装置中,最合理的是______。(选填序号)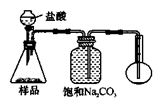
A B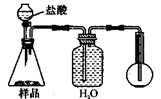
C D
(18分)工业生产的纯碱中常含有少量NaCl杂质。为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
【方案二】用0.100 mol/L盐酸滴定。
【方案三】用稀酸将CO32-转化为CO2,测定CO2的质量。
解答1-4小题:
1.方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作。称量时所需定量实验仪器为____________________。判断是否达到恒重的标准是_____________________________________________________。
2.方案二的具体过程为:
①操作1所需要的仪器有_____________________________________________。
②滴定时选择的指示剂为甲基橙。当溶液____________________________________时,说明达到了滴定终点。
③为减少偶然误差,通常的处理办法是_______________________________。
④滴定时若锥形瓶内有少量液体溅出,则测定结果_________。(选填“偏高”、“偏低”、“不影响”,下同),若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,测定结果_________。
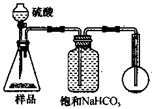
3.方案三的实验装置如下图:
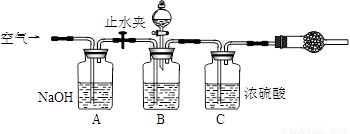
操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥ 打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g。
该方案样品中纯碱的质量分数为__________________________(用代数式表示)。
上图中装置A的作用是_____________________。装置C的作用是_____________________。有同学认为空气中的水蒸气会进入干燥管导致测量结果_____________(填“偏大”、“偏小”或“无影响”)。改进措施可以是______________________________________________。
4.若用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量。则下列装置中,最合理的是______。(选填序号)
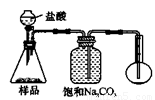
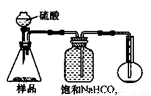
A B
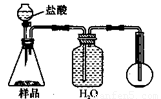
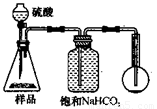
C D
工业生产的纯碱中常含有少量NaCl杂质。为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
【方案二】用0.100 mol/L盐酸滴定。
【方案三】用稀酸将CO32-转化为CO2,测定CO2的质量。
解答31-34小题:
方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作。称量时所需定量实验仪器为____________________。判断是否达到恒重的标准是_____________________________________________________。
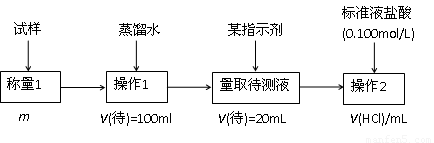
方案二的具体过程为:
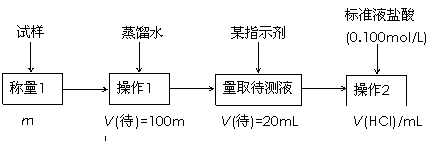 |
①操作1所需要的仪器有_____________________________________________。
②滴定时选择的指示剂为甲基橙。当溶液____________________________________时,说明达到了滴定终点。
③为减少偶然误差,通常的处理办法是_______________________________。
④滴定时若锥形瓶内有少量液体溅出,则测定结果_________。(选填“偏高”、“偏低”、“不影响”,下同),若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,测定结果_________。
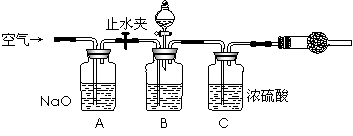 方案三的实验装置如下图:
方案三的实验装置如下图:
操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥ 打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g。
该方案样品中纯碱的质量分数为__________________________(用代数式表示)。
上图中装置A的作用是_____________________。装置C的作用是_____________________。有同学认为空气中的水蒸气会进入干燥管导致测量结果_____________(填“偏大”、“偏小”或“无影响”)。改进措施可以是______________________________________________。
若用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量。则下列装置中,最合理的是______。(选填序号)
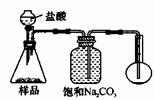
A B
C D
 工业上制纯碱的方法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱(纯碱样品中Na2CO3的质量分数为92%~96%)。涉及到的化学方程式有:
工业上制纯碱的方法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱(纯碱样品中Na2CO3的质量分数为92%~96%)。涉及到的化学方程式有:
NH3+CO2+H2O → NH4HCO3,NH4HCO3+NaCl(饱和)→ NaHCO3↓+NH4Cl,![]() 。请回答:
。请回答:
(1)工业制得的纯碱中常常含有少量的氯化钠杂质,其主要原因是 。
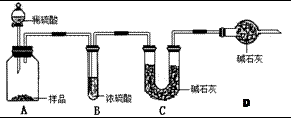
(2)现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计如下方案,请你帮助他们完成如下实验。
甲:用 (填实验仪器)称取10.0g样品,利用上图所示装置,测出反应后装置C中碱石灰增重3.52g。装置D中碱石灰的作用是 。
乙:准确称取10.00g样品后,用 (填实验仪器)配成1000mL溶液,用
式滴定管量取25.00mL放入锥形瓶中,加入2滴酚酞作指示剂,用0.15mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+HCl → NaCl+NaHCO3)。完成三次平行实验后,消耗盐酸体积的平均值为15.00mL。
丙:准确称取10.00g样品后,向其中加入过量的盐酸,充分反应直至样品中无气泡冒出,蒸干混合溶液将所得到固体物质于干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。请分析、计算后填表:
| 分析与计算 分组 | 计算样品中碳酸钠的质量分数 | 实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲 |
| 失 败 | |
| 乙 |
|
| |
| 丙 |
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com