
题目列表(包括答案和解析)
(1)
元素 |
| |
相同点 | 颜色 |
|
毒性 |
| |
溶解性 |
| |
递变性 | 状态 |
|
颜色 |
| |
密度变化规律 |
| |
熔、沸点变化规律 |
| |
在水中溶解度变化规律 |
| |
(2)
元素 |
| |
与H2反应 | 相同点 | 均与H2反应生成___________ |
递变性 | 从F2到I2,与H2化合条件_________,HX的稳定性逐渐_________ | |
卤素间的置换反应 | Cl2+NaBr | |
结论 | 从F到I,非金属性逐渐;单质的氧化性逐渐 | |
实验过程 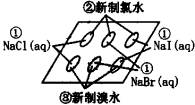
反应原理
实验现象
实验结论
关于同主族元素性质递变的综合实验结论是________________。
(1)比较元素的单质与水(或酸)反应置换出_____________的难易程度。置换反应越_____________,元素原子的失电子能力_____________。
(2)比较元素最高价氧化物对应水化物的碱性强弱。一般说来,碱性___________,元素原子失电子的能力___________。
(3)金属单质间的置换反应。若X金属能把Y金属从它的盐溶液中置换出来,则X金属原子失电子能力比Y_____________。
(4)金属阳离子的氧化性强弱。一般来说,对主族元素而言,最高价金属阳离子的氧化性越__________,则金属元素原子的失电子能力越___________。
| A、①中产生气体的电子式是Cl:Cl | B、上述实验中,共有两个氧化还原反应 | C、实验②中FeCl2被氧化 | D、实验③发生的是同主族元素单质间的置换反应 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com