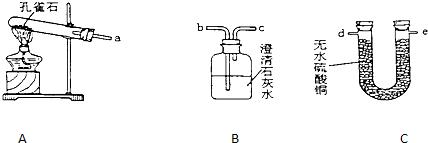
小伟生日,妈妈做了很多菜,小伟发现妈妈将拌了“安多夫”粉的肉类加入食醋腌制时产生大量气泡,引发了极大的兴趣.
【查阅资料】“安多夫”是一种嫩肉粉,可破坏肉质纤维结构,使肉质松软,其成分中含有碳酸氢钠(NaHCO
3).小伟联想已经学过的碳酸钠(Na
2CO
3),其与碳酸氢钠比较,组成元素只相差一种元素氢元素,决定与化学兴趣小组的同学一道,对碳酸钠和碳酸氢钠的性质的异同点进行初步探究.
【提出问题】碳酸钠和碳酸氢钠的性质有哪些相同点和不同点?
【猜想1】碳酸氢钠溶液呈碱性.
【进行实验1】
【猜想2】碳酸氢钠能与盐酸反应
【进行实验2】
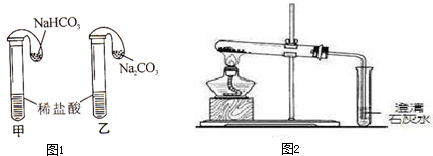
将气球中的碳酸氢钠粉末、碳酸钠粉末分别加入试管中(如图1),气球迅速胀大,说明碳酸氢钠能与盐酸发生化学反应.请写出碳酸氢钠与盐酸反应的化学反应方程式
NaHCO3+HCl═NaCl+H2O+CO2↑
NaHCO3+HCl═NaCl+H2O+CO2↑
.
【交流与讨论1】
通过上述两个实验结果,小伟同学得出结论:
碳酸氢钠与碳酸钠的化学性质相似.
其他同学对小伟的结论提出质疑,认为两者组成不完全相同,化学性质应有区别.于是,同学们设计并进行以下甲、乙两个对比实验,实验装置如图2所示,请你参与,完成下列表格中的空白.
【交流与讨论1】
| |
实验步骤 |
实验现象 |
实验结论 |
| 实验甲 |
取碳酸氢钠样品少许加入试管中, 加热,并将产生的气体通入澄清的石灰水中 加热,并将产生的气体通入澄清的石灰水中 . |
1.试管壁上有水珠.
2.石灰水变浑浊 石灰水变浑浊 |
反应生成了 水 水 和二氧化碳. |
| 实验乙 |
取碳酸钠样品少许重复实验甲的操作. |
无明显现象 无明显现象 |
碳酸钠受热不分解 |
【交流与讨论2】
(1)根据实验甲写出碳酸氢钠受热分解的化学方程式
;
(2)通过实验探究大家明白了,碳酸氢钠与碳酸钠的化学性质既有相同之处,又有不同之处,物质的组成是决定物质
性质
性质
的重要因素之一.
(3)“安多夫”在使用和贮存过程中应注意哪些问题
干燥密封、阴凉处,避免与酸性物质接触等等
干燥密封、阴凉处,避免与酸性物质接触等等
(至少说出一点).