
题目列表(包括答案和解析)
| |||||||||||||||
| |||||||||||||||
(7分)将镁和铝的混合物0.1 mol溶于100 mL 2 mol/L的H2SO4溶液中,然后滴加1 mol/L的NaOH溶液。在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液的体积(V)变化如图所示。请回答:
(1)若当V1=160时,则金属粉末中
n(Mg)= mol,V2= mL;
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积应为 mL。
(7分)将镁和铝的混合物0.1 mol溶于100 mL 2 mol/L的H2SO4溶液中,然后滴加1 mol/L的NaOH溶液。在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液的体积( V)变化如图所示。请回答:
V)变化如图所示。请回答: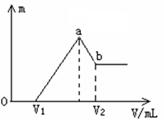
(1)若当V1=160时,则金属粉末中
n(Mg)= mol,V2= mL;
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积应为 mL。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com