(2010?定海区模拟)A、B、C、D、E为五种短周期主族元素,且原子序数依次增大.A与D、C与E分别同主族,E的原子最外层电子数比次外层少2个.A与B可以按照原子个数比3:1形成化合物甲,且每个甲分子中含有10个电子.请回答:
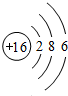
(1)E的原子结构示意图是
,B单质分子的电子式是
.
(2)甲溶于水所得溶液呈碱性的原因是(用电离方程式表示)
NH
3?H
2O
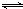
NH
4++OH
-NH
3?H
2O
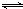
NH
4++OH
-.
(3)A与D形成的离子化合物能与H
2O反应得到强碱溶液和H
2,写出该反应的化学方程式
NaH+H2O=NaOH+H2↑
NaH+H2O=NaOH+H2↑
.在该反应中,氧化剂与还原剂的物质的量之比是
1:1
1:1
.
(4)X、Y、Z为三种强电解质,分别由上述五种元素中的三种组成.X、Y、Z的稀溶液之间存在如下转化关系:
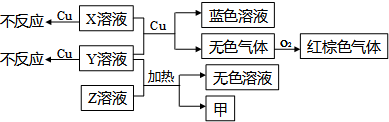
①用离子方程式表示Y溶液呈酸性的原因是
NH
4++H
2O
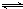
NH
3?H
2O+H
+NH
4++H
2O
NH
3?H
2O+H
+;
②金属Cu与X、Y的混合溶液反应的离子方程式是:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.


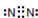
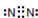
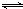 NH4++OH-
NH4++OH-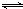 NH4++OH-
NH4++OH-
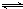 NH3?H2O+H+
NH3?H2O+H+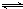 NH3?H2O+H+
NH3?H2O+H+