
题目列表(包括答案和解析)
孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物。以下是实
验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:
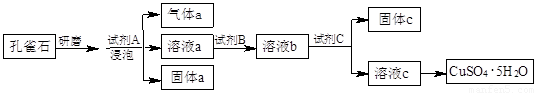
(1)研磨孔雀石的目的是 。浸泡孔雀石的试剂A若选用过量的稀硫酸,则固体a是 (填化学式)。
(2)试剂B的目的是将溶液中的Fe2+转化为Fe3+,则试剂B宜选用 (填序号):
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
相应的离子方程式为: 。
(3)试剂C用于调节溶液pH,使Fe3+转化为沉淀予以分离。则试剂C宜选用 (填序号):
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuO
固体C的化学式为 。
(4)1 mol氨气通过加热的Cu2(OH)2 CO3可以产生1.5 mol金属铜,则该反应的化学方程式为 。
(5)常温下Fe(OH)3的Ksp=1×10-39,若要将溶液中的Fe3+转化为Fe(OH)3沉淀,使溶液中c(Fe3+)降低至1×10—3 mol/L,必需将溶液调节至pH= 。
重铬酸盐广泛用作氧化剂、皮革制作等。以铬矿石(主要成分是Cr2O3,含FeO、Al2O3、 SiO2等杂质)为原料制取重铬酸钠的流程如下:
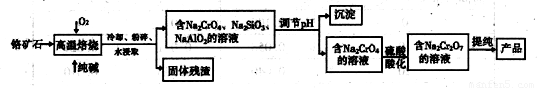
请回答下列问题:
(1)写出Cr2O3在高温焙烧时反应的化学方程式______________________
(2)写出硫酸酸化使Na-2CrO4转化为Na2Cr2O7的离子方程式 ______________。
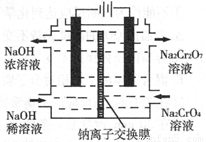
(3)某工厂采用石墨电极电解Na2CrO4溶液,实 现了 Na2CrO4到 Na2Cr2O7的转化,其原理如图所示。
①钠离子交换膜的一种材料是聚丙烯酸钠(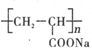 ),聚丙烯酸钠单体的结构简式是________;
),聚丙烯酸钠单体的结构简式是________;
②写出阳极的电极反应式__________
(4) Na2Cr2O7可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化 所需要O2的质量)。现有某水样100.00 mL,酸化后加入C1 mol/L的Na2Cr2O7溶液 V1 mL,使水中的还原性物质完全被氧化(Cr2O72-还原为Cr3+);再用C2mol/L的FeSO4溶液滴定剩 余的Cr2O72-,结果消耗FeSO4溶液V2 mL。
①该水样的COD为______________mg/L;
②假设上述反应后所得溶液中Fe3+和Cr3+的物质的量浓度均为0.1 mol/L,要使Fe3 +沉 淀完全而Cr3+还未开始沉淀.则需调节溶液pH的范围是 _______.
(可能用到的数据:KSPFe(OH)3=4.0×10-38, KSPCr(OH)3=6.0×10-31,
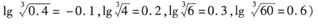
CuSO4•5H2O是一种重要的化工原料。实验室以Cu为原料制取CuSO4·5H2O
![]() 有如下方法:
有如下方法:
方法一:
 (1)该方法中金属铜应在 (填仪器名称)中灼烧。
(1)该方法中金属铜应在 (填仪器名称)中灼烧。
方法二:
(2)该方法中少量![]() 起催化作用,其催化机理为(用离子方程式表示)
起催化作用,其催化机理为(用离子方程式表示)
![]() , 。调节溶液PH3~4,可使
, 。调节溶液PH3~4,可使![]() 完全转化为
完全转化为![]() 沉淀,调节时加入的试剂为 。
沉淀,调节时加入的试剂为 。
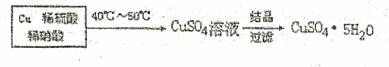 方法三:
方法三:
(3)①该方法中首先要将Cu与稀硫酸和稀硝酸混合。为了只得到
 CuSO4溶液,需向100mLl.0moI• L-1稀硝酸中加入 mL 1.0mol·L-1稀硫酸与之混合。
CuSO4溶液,需向100mLl.0moI• L-1稀硝酸中加入 mL 1.0mol·L-1稀硫酸与之混合。
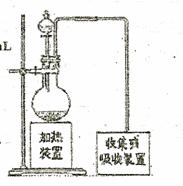
②Cu与稀硫酸和稀硝酸的反应装置如右图所示:
实验室中对圆底烧瓶加热的最佳方式是 ;
装置中圆底烧瓶上方长导管的作用是 。
③下列可做为右图中尾气收集或吸收装置的是 (填字母)。
(提示:![]()

(4)上述方法中,方法一耗能大,方法二步骤多,方法三生成有毒气体。请综合考虑有关
设 计 因 素 , 设 计 一 个 实 验 室 制 备 CuSO4·5H2O的 方 案 流 程
图 。
供选择的试剂:Cu、![]() 、
、![]() 、
、![]() 、浓硫酸、稀盐酸、稀硫酸等
、浓硫酸、稀盐酸、稀硫酸等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com