(2010?绵阳模拟)铝土矿(主要成分为Al
2O
3、SiO
2、Fe
2O
3)是提取氧化铝的原料.提取氧化铝的流程如下:
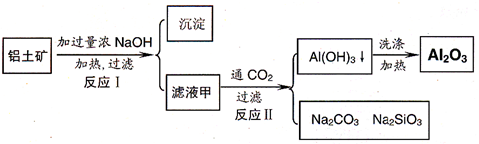
(1)滤液甲的主要成分是
NaOH、NaAl(OH)4(NaAlO2)、Na2SiO3[或氢氧化钠、铝酸钠(偏铝酸钠)、硅酸钠]
NaOH、NaAl(OH)4(NaAlO2)、Na2SiO3[或氢氧化钠、铝酸钠(偏铝酸钠)、硅酸钠]
(2)写出反应 II 的离子方程式:
CO2+2OH-═CO32-+H2O,CO2+3H2O+2AlO2-═2Al(OH)3↓+2H2O-+CO32-
CO2+2OH-═CO32-+H2O,CO2+3H2O+2AlO2-═2Al(OH)3↓+2H2O-+CO32-
(3)结合反应II,判断下列微粒结合质子 ( H
+) 的能力,由强到弱的顺序是
bac
bac
(填字母序号)
a.AlO
2-或Al(OH)
4- b.OH
- C.SiO
32-(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀部分消失.写出阴极的电极反应方程式
2H2O+2e-═2OH-+H2↑
2H2O+2e-═2OH-+H2↑
,沉淀部分消失的原因可用离子方程式表示为:
Al(OH)3+OH-═Al(OH)4-或Al(OH)3+OH-═AlO2-+2H2O
Al(OH)3+OH-═Al(OH)4-或Al(OH)3+OH-═AlO2-+2H2O
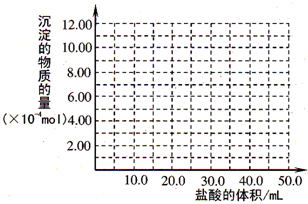
(5)取(4)电解以后的溶液 10.0mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100mol?L
-1 盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解.请画出生成沉淀的物质的量与加入盐酸体积的关系图.



 下面有关PHB说法错误的是( )
下面有关PHB说法错误的是( )