
题目列表(包括答案和解析)
下列溶液:①pH=0的盐酸(至)0.5 mol?L-1盐酸③0.1 mol?L-1的NH4Cl溶液④0.1 mol?L-1的NaOH溶液 ⑤0.5 mol?L-1的NH4Cl溶液,以上溶液中由水电离的c(H+)由大到小的顺序是
A.⑤③④②① B.①②③⑤④ C.①②③④⑤ D.⑤③④①②
|
下列有关电解质溶液中微粒的物质的量浓度关系正确的是 | |
| [ ] | |
A. |
0.1 mol·L-1某二元弱酸酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
B. |
25℃,pH=12的氨水和pH=2的盐酸溶液等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
C. |
将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 |
D. |
向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH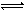 CH3COO-+H+ ΔH>0
CH3COO-+H+ ΔH>0
(1)常温下,pH=5醋酸溶液中,c(CH3COO-)=______mol/L(精确值,要求列式不必化简);
(2)下列方法中可以使0.10 mol·L-1 CH3COOH的电离程度增大的是
a.加入少量0.10 mol·L-1稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸 e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1 NaOH溶液
(3)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸)(填“大于”、“小于”或“等于”)
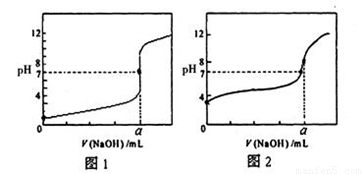
(4)用NaOH溶液分别滴定20.00mL0.1mol/L盐酸和20.00mL0.1mol/L醋酸溶液,得到如图所示两条滴定曲线,用NaOH溶液滴定醋酸溶液的曲线是 (填“图1”或“图2”)
(5)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(6)下图表示溶液中c(H+)和c(OH-)的关系
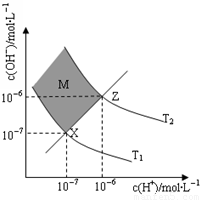
①M区域内(阴影部分)任意点c(H+)______c(OH-)(填“大于”、“小于”或“等于”)
②在T2温度下,将pH=9 NaOH溶液与pH=4 HCl溶液混合,若所得混合溶液的pH=7,则NaOH溶液与HCl溶液的体积比为 。(混合后溶液体积的变化忽略不计)
醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0
CH3COO-+H+ ΔH>0
(1)常温下,pH=5醋酸溶液中,c(CH3COO-)=______mol/L(精确值,要求列式不必化简);
(2)下列方法中可以使0.10 mol·L-1 CH3COOH的电离程度增大的是
a.加入少量0.10 mol·L-1稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸 e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1 NaOH溶液
(3)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸)(填“大于”、“小于”或“等于”)
(4)用NaOH溶液分别滴定20.00mL0.1mol/L盐酸和20.00mL0.1mol/L醋酸溶液,得到如图所示两条滴定曲线,用NaOH溶液滴定醋酸溶液的曲线是 (填“图1”或“图2”)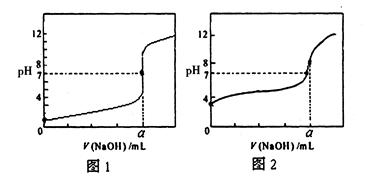
(5)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(6)下图表示溶液中c(H+)和c(OH-)的关系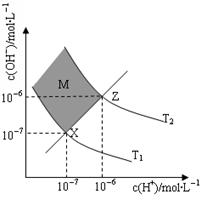
①M区域内(阴影部分)任意点c(H+)______c(OH-)(填“大于”、“小于”或“等于”)
②在T2温度下,将pH=9 NaOH溶液与pH=4 HCl溶液混合,若所得混合溶液的pH=7,则NaOH溶液与HCl溶液的体积比为 。(混合后溶液体积的变化忽略不计)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com