(2011?扬州三模)还原铁粉是粉末冶金工业的重要原料,利用生产钛白的副产品绿矾制备还原铁粉的工业流程如下:
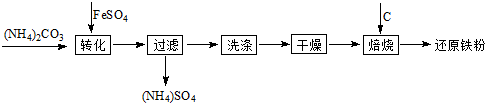
(1)干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO
3?nH
2O被空气氧化为FeOOH,其化学方程式为
4FeCO3?nH2O+O2=4FeOOH+4CO2↑+(4n-2)H2O
4FeCO3?nH2O+O2=4FeOOH+4CO2↑+(4n-2)H2O
.
(2)取干燥后的FeCO
3样品12.49g焙烧至600℃,质量变为8.00g,继续加热最终得到Fe 6.16g,则600℃产物的可能组成为
FeO与Fe2O3或FeO与Fe3O4或FeO、Fe2O3、Fe3O4
FeO与Fe2O3或FeO与Fe3O4或FeO、Fe2O3、Fe3O4
,计算FeCO
3样品中FeCO
3与FeOOH的质量
FeCO3:11.6 g,FeOOH:0.89 g
FeCO3:11.6 g,FeOOH:0.89 g
.
(3)若将28.12g还原铁粉(含少量Fe
xC)在氧气流中加热,得到标准状况下的CO
2224mL;将相同质量的还原铁粉与足量硫酸反应,得到标准状况下的H
2 10.752L,计算Fe
xC的化学式为
Fe2C
Fe2C
.(假设还原铁粉仅含两种物质)

