
题目列表(包括答案和解析)
(6分)(1)如下图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是________________。
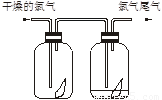
(2)实验室为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_____________溶液吸收多余的氯气。
工业上常用廉价的石灰乳吸 收工业氯气尾气制得漂白粉,漂白粉的有效成分是___________(均填化学式),
长期露置于空气中的漂白粉,加稀盐酸后产生的气体是___________(用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
(3)当氯气泄漏人们逃离现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是____ ___。
A.NaOH B.NaCl C.KBr D.Na2CO3
(4)氯气和二氧化硫都有毒,但将两者等物质的量混合通入水中毒性会消失,用离子方程式表示毒性消失的原因
(6分)(1)如下图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是________________。
(2)实验室为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_____________溶液吸收多余的氯气。
工业上常用廉价的石灰乳吸 收工业氯气尾气制得漂白粉,漂白粉的有效成分是___________(均填化学式),
长期露置于空气中的漂白粉,加稀盐酸后产生的气体是___________(用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
(3)当氯气泄漏人们逃离现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是____ ___。
A.NaOH B.NaCl C.KBr D.Na2CO3
(4)氯气和二氧化硫都有毒,但将两者等物质的量混合通入水中毒性会消失,用离子方程式表示毒性消失的原因
(6分)(1)如下图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是________________。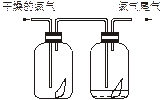
 (2)实验室为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_____________溶液吸收多余的氯气。
(2)实验室为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_____________溶液吸收多余的氯气。
工业上常用廉价的石灰乳吸 收工业氯气尾气制得漂白粉,漂白粉的有效成分是___________(均填化学式),
长期露置于空气中的漂白粉,加稀盐酸后产生的气体是___________(用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
(3)当氯气泄漏人们逃离现场时,可以用浸有一定浓度的某种物质的水溶液 的毛巾捂住鼻子,最适宜采用的该物质是____ ___。
的毛巾捂住鼻子,最适宜采用的该物质是____ ___。
A.NaOH B.NaCl C.KBr D.Na2CO3
(4)氯气和二氧化硫都有毒,但将两者等物质的量混合通入水中毒性会消失,用离子方程式表示毒性消失的原因

| ||
| ||
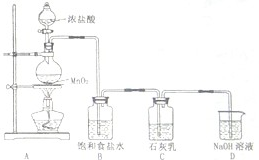 海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
| ||
| ||
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com