
题目列表(包括答案和解析)
(14分)钠的化合物在工农业生产和人们的日常生活中有着广泛的应用,其中Na2O2常用作漂白剂和潜水艇中的供氧剂。Na2O2有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能反应。为了验证此推测结果,该同学设计并进行如下实验,实验步骤和现象如下。
步骤1:按下图组装仪器(图中夹持仪器省略)并检查装置的气密性,然后装入药品;
步骤2:打开K1、K2,产生的氢气在流经装有Na2O2的硬质玻璃管的过程中,没有观察到任何现象;
步骤3:检验完H2的纯度后,点燃酒精灯加热,观察到硬质玻璃管内Na2O2逐渐熔化,淡黄色的粉末慢慢变成了白色固体,干燥管内硫酸铜未变蓝色;
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
根据以上信息回答下列问题:
(1)组装好仪器后,要检查装置的气密性。简述检查K2之前装置气密性的方法 ;利用A装置制备气体的优点是 (写出1点即可);实验室利用A装置还可以制备的气体是 (写出1种即可)。
(2)盛装CuSO4药品的仪器名称是 ;B装置的作用是 。
(3)必须检验氢气纯度的原因是 。
(4)设置装置D的目的是 。
(5)由上述实验可推出Na2O2与H2反应的化学方程式为 。
新型无机非金属材料甲和乙均是高温陶瓷材料,硬度大、熔点高、化学性质稳定。甲、乙分别由原子序数依次增大的X、Y、Z三种短周期元素中的两种组成。甲与NaOH浓溶液共热生成气体丙和化合物丁,丙在标准状况下的密度为0.76g·L-1,在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解。Z元素的氧化物是制造光导纤维的主要材料,在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙。请回答下列问题:
(1)乙的化学式为__________;丙的电子式为__________。
(2)甲与NaOH浓溶液共热的化学方程式为__________________________________________。
(3)丁溶液中通入少量CO2的离子方程式为________________________________________。
(4)高温条件下,丙与Fe2O3反应生成Fe和X单质,写出该反应的化学方程式为____________________,有人提出生成的产物Fe中可能还有FeO,请设计实验方案验证之(用化学方法)____________________。
(5)工业上在X单质的气氛下将Z的氧化物和焦炭加热到1400℃~1450℃的条件下以制备乙,反应中还生成一种常见的可燃性气体戊,该反应的化学方程式为____________________。
新型无机非金属材料甲和乙均是高温陶瓷材料,硬度大、熔点高、化学性质稳定。甲、乙分别由原子序数依次增大的X、Y、Z三种短周期元素中的两种组成。甲与NaOH浓溶液共热生成气体丙和化合物丁,丙在标准状况下的密度为0.76g·L-1,在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解。Z元素的氧化物是制造光导纤维的主要材料,在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙。请回答下列问题:
(1)乙的化学式为__________;丙的电子式为__________。
(2)甲与NaOH浓溶液共热的化学方程式为__________________________________________。
(3)丁溶液中通入少量CO2的离子方程式为________________________________________。
(4)高温条件下,丙与Fe2O3反应生成Fe和X单质,写出该反应的化学方程式为____________________,有人提出生成的产物Fe中可能还有FeO,请设计实验方案验证之(用化学方法)____________________。
(5)工业上在X单质的气氛下将Z的氧化物和焦炭加热到1400℃~1450℃的条件下以制备乙,反应中还生成一种常见的可燃性气体戊,该反应的化学方程式为____________________。
金属与金属材料

1.重要的黑色金属材料——钢铁
(1)生铁:硬度大,质脆、不易加工,含C量高.
(2)钢:性能优于生铁,含C量低,易锈蚀.
(3)不锈钢:含Cr、Ni等元素的钢材.
2.几种有色金属材料——金、银、铜
(1)Au、Ag、Cu的主要物理性质
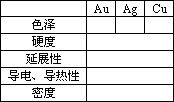
(2)Au、Ag、Cu的化学性质
①Au、Ag、Cu都是不活泼金属,化学稳定性:Au>Ag>Cu.
②Cu的化学性质:
铜的锈蚀:
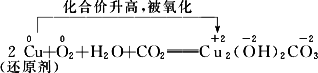
加热或点燃条件下,铜跟非金属的反应
2Cu+O2![]() ________,
________,
2Cu+S![]() ________.
________.
(3)含Cu化合物间的相互转化
4CuO![]() 2Cu2O+O2↑
2Cu2O+O2↑
CuSO4·5H2O![]() CuSO4+5H2O↑
CuSO4+5H2O↑
Cu2(OH)2CO3![]() 2CuO+H2O↑+CO2↑
2CuO+H2O↑+CO2↑
(4)Au、Ag、Cu的应用
①Au的应用
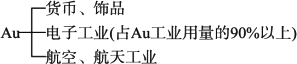
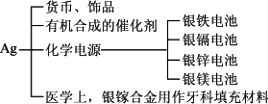
②Ag的应用
③Cu的应用

(5)未来的钢铁——钛(Ti)
钛表面易形成致密的氧化物保护膜,抗蚀力强.
钛具有熔点高、硬度大、可塑性强、密度小等优点.
钛应用范围广泛:可用于制造飞机、飞船、火箭、导弹、舰艇、化工设备、纺织设备、医疗器械等,还可以制成“人造骨骼”.
A的单质和B的单质在加热条件下激烈反应,得到化合物X,X的蒸汽是同温同压下空气密度的5.86倍,X遇过量水激烈反应并放出大量白色烟雾,反应完全后的混合物加热蒸干得一难溶物,后者在空气中经1000℃以上高温灼烧,得到化合物Y.Y的一种晶体的结构与金刚石结构类似.A原子的位置相当于碳原子在金刚石中的位置,但Y结构中A原子并不直接相连,而是通过E原子相连,X与过量氨反应完全后得到含A的化合物Z,而Z在无氧条件下经高温灼烧得化合物G,G是一种新型无机非金属材料.
(1)写出X、Y的化学式;
(2)写出G的化学式:
(3)推断G可能的物理性质(熔点及硬度)并计G的同类.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com