我国西部地区拥有非常丰富的盐湖资源,对盐湖矿产资源的综合开发利用是西部大开发的重要课题之一。某校实验小组拟采用盐湖苦卤(富含K+、Mg2+、Br-、SO42-、Cl-等)为原料,制取较纯净的无水MgCl2、KCl晶体及液溴(Br2),他们设计了如下实验方案:
提供的相关信息如下
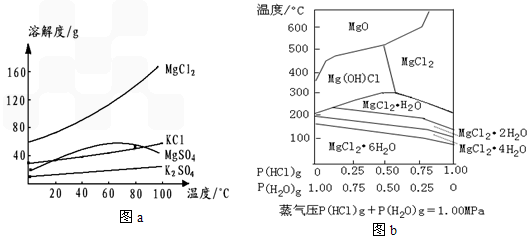
①KCl,MgCl2,K2SO4,MgSO4在水中的溶解度随温度变化的关系如下图a所示
②温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如下图b所示
③Ksp[Mg(OH)2]=1.6×10-11
HCl-H2O气氛下的MgCl2-MgO分布图
请根据以上信息回答下列问题:
(1)操作1中的无色有机溶剂可以选择________________。
A.四氯化碳 B.乙醇 C.苯 D.己烯
(2)操作2的名称为__________。
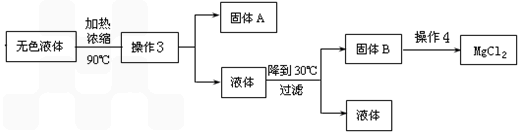
(3)在方案1中甲同学采用了以下实验流程得到了无水MgCl2
①操作3所得固体A是___________(填化学式);
②写出操作4中,P(HCl)g=0.25MPa,温度从300℃升高到550℃时反应的化学方程式______________________;
③实际生产中,将MgCl2·6H2O晶体加热失水得到无水MgCl2的适宜条件是____________。
(4)乙同学在方案2中,对上述操作1后无色溶液进行除杂提纯,得到了KCl晶体,其实验步骤如下:
①假设试剂B是一种正盐,则B的化学式为_________________;
②操作⑤中除了用到铁架台(带铁圈)、蒸发皿外,还用到哪些玻璃仪器? __________;
③实验过程中,为确保Mg2+完全除尽,应调节溶液的pH≥_________(结果保留1位小数,且假设离子浓度小于10-6mol/L可视作已被完全除尽,lg2=0.3)。