
题目列表(包括答案和解析)
下表为长式周期表的一部分,其中的序号代表对应的元素。

(1)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为
杂化, 键与
键与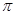 键的个数比为
。
键的个数比为
。
(2)元素③、④、⑤、⑥的第一电离能由大到小的顺序为 。其中⑥元素核外电子的电子排布图为 。
(3)③元素形成的最高价氧化物所形成的晶胞边长为acm,则其晶胞密度为 ;
(4)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,还原产物没有气体,该反应的离子方程式为 。
(5)元素③与⑤形成的原子个数比为1:1化合物能与⑩的单质形成形式为A(BC)5的配合物,该配合物常温下为液态,易溶于非极性溶剂,其晶体类型 ,该配合物在一定条件下分解生成⑩的单质和③与⑤形成的原子个数比为1:1化合物,则在分解过程中破坏的化学键为 ,形成的化学键为 。
(6)化学上有一种见解,认为同种元素形成的含氧酸中该成酸元素的化合价越高,酸性越强,请用表中的元素举例说明(酸性由强到弱的顺序) 。
气体X可能Cl2、HBr、CO2中的一种或几种,已知X通入AgNO3溶液时产生淡黄色沉淀,且沉淀不溶于稀硝酸;若将X通入澄清的石灰水中,却不见沉淀产生,则对气体X的成分,下列说法正确的是 ( )
A.一定含有HBr,一定不含CO2 B.一定含有HBr,可能含有CO2
C.一定不含Cl2 D.可能含有CO2、Cl2
[ ]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com