
题目列表(包括答案和解析)
用符合八偶律的路易斯结构式能不能解释氧分子里有未成对电子的客观事实(氧气有顺磁性,实验证明,顺磁性是分子里有未成对电子的宏观表现)。怎样用分子轨道理论来解释氧气的顺磁性?
| 分子或离子 | 孤对电子对数 | 杂化轨道数 | 中心原子轨道杂化形式 | 分子或离子的立体结构 | ||
| NH3 | ||||||
| BeCI2 | ||||||
| SO3 | ||||||
NH
|
||||||
SO
|
||||||
| NCI2 |
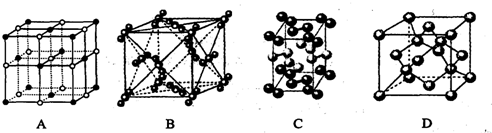
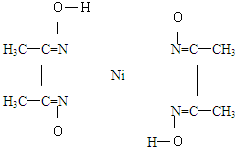
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com