
题目列表(包括答案和解析)
(16分)I、用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+ CO2(g)+2H2O(g) △H=" -574" kJ·mol-l
②CH4(g)+4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H=" -1160" kJ·mol-l
③H2O(g)=H2O(1) △H=-44.0 kJ·mol-l
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式____ 。
II、开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物赢接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)-CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(a)与温度、压强的关系如图所示。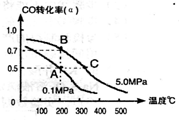
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=____ ;
②若A、C两点都表示达到的平衡状态,则白反应开始到达平衡状态所需的时间tA tC(填 “>”、“<”或“=”)。
(2)日前工业上也可以用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)△H<0,若将6mo1 CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)△H<0,若将6mo1 CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
①若改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变可能是 ,曲线II对应的实验条件改变可能是____ 。
②请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
III、用MnO2制KMnO4的工艺流程如图:电解池中两极材料均为碳棒,在水或酸性溶液中K2MnO4发生歧化而变成MnO2和KMnO4。
①写出240℃熔融时发生反应的化学方程式 ,投料时必须满足n(KOH):n(MnO2) 。
②阳极的电极反应为 。
③B物质是 (填化学式),可以循环使用的物质是 (填化学式)。
(14分)请根据所学的电化学原理,解决以下问题。
(1)依据氧化还原反应:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s) 设计的双液原电池,可以提供稳定的电流。装置如图所示,其中盐桥中装有琼脂—饱和KCl溶液。
回答下列问题:
①电极X的材料和电解质溶液Y分别为 ;
②盐桥中K+移向 (填A或B);
③银电极发生的电极反应为 。
(2)下图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
①若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液, (填X或Y)电极附近先变红色, X极上的电极反应式为 。
②若要在铁制品上镀一定厚度的Cu层,Y电极反应式为
③若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2 g。该金属的相对原子质量是 ;
(14分)请根据所学的电化学原理,解决以下问题。
(1)依据氧化还原反应:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s) 设计的双液原电池,可以提供稳定的电流。装置如图所示,其中盐桥中装有琼脂—饱和KCl溶液。
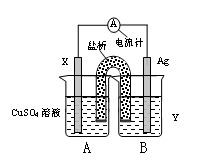
回答下列问题:
① 电极X的材料和电解质溶液Y分别为 ;
② 盐桥中K+移向 (填A或B);
③ 银电极发生的电极反应为 。
(2)下图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
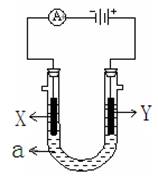
①若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液, (填X或Y)电极附近先变红色, X极上的电极反应式为 。
② 若要在铁制品上镀一定厚度的Cu层,Y电极反应式为
③ 若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2 g。该金属的相对原子质量是 ;
| ||
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1= +489.0 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ/mol
则CO还原Fe2O3的热化学方程式为 ;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO。PdCl2被还原成单质,反应的化学方程式为 ;
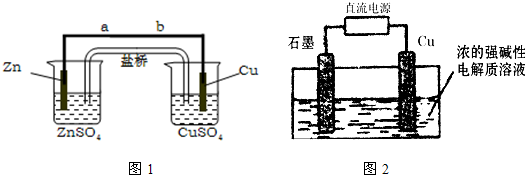
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池。
①负极电极反应式是: ;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)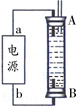
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com