
题目列表(包括答案和解析)
铁是日常生活中最常见的金属,某班同学在学习铁的知识时,有下列问题:
问题1:铁为何称为黑色金属?
问题2:CuO在高温下可分解为 Cu2O和O2,Fe2O3在高温下可分解为FeO和O2吗?
(1)对于问题1,同学们上网查找,有两种解释:
A.因为在铁表面上有黑色的铁的氧化物,所以叫黑色金属
B.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属
①你认为正确的说法是__________。
②若有一黑色粉末,如何鉴别是铁粉,还是Fe3O4?______________________________________。
③若有一黑色粉末,为铁和四氧化三铁的混合物,如何证明其中有Fe3O4(只要求简述实验方法)?____________________________________。
(2)对于问题2,同学们准备实验探究,他们设想了两种方法:
A.将三氧化二铁高温灼烧,看灼烧前后颜色是否变化。
B.将三氧化二铁高温灼烧,看灼烧前后质量是否变化。
①实验中应将Fe2O3放在__________(填仪器名称)中灼烧。
②方法A中,如果高温灼烧后颜色由__________变为__________,说明Fe2O3确实发生了变化。能说明生成的一定为FeO吗?__________,理由是________________________。
③方法B中,如果发生了预期的反应,固体高温灼烧前后质量比应为________,但是,实验结果固体灼烧前后质量比为30∶29,则高温灼烧后生成物是____________________。
④比较两种方法,你认为较好的方法是__________。
铁是日常生活中最常见的金属,某班同学在学习铁的知识时,有下列问题:
问题1:铁为何称为黑色金属?
问题2:CuO在高温下可分解为Cu2O和O2,Fe2O3在高温下可分解为FeO和O2吗?
(1)对于问题1,同学们上网查找,有两种解释:
A.因为在铁表面有黑色的铁的氧化物,所以叫黑色金属
B.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属
①你认为正确的说法是____________。
②若有一黑色粉末,如何鉴别是铁粉,还是Fe3O4粉末:
____________ 。
③若有一黑色粉末,为铁和四氧化三铁的混合物,如何证明其中有Fe3O4(只要求简述实验方法):____________ 。
(2)对于问题2,同学们准备实验探究,他们设想了两种方法:
A.将三氧化二铁高温灼烧,看灼烧前后颜色是否变化
B.将三氧化二铁高温灼烧,看灼烧前后质量是否变化
①实验中应将Fe2O3放在____________(填仪器名称)中灼烧。
②方法A中,如果高温灼烧后颜色由____________变为____________ ,
说明Fe2O3确实发生了变化。能说明生成的一定为FeO吗?____________(填“能”或“不能”)。理由是____________。
③方法B中,如果发生了预期的反应,固体高温灼烧前后质量比应为____________,但是,实验结果是固体灼烧前后质量比为30∶29,则高温灼烧后生成物是____________。
④比较两种方法,你认为较好的方法是____________。
氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。为探究氨气的性质,某研究性学习小组做了以下实验:
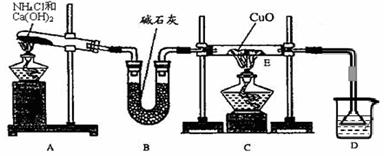
⑴ 实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气。
① 实验室制取氨气的化学方程式为 。
② 若用加热碳酸氢铵固体制取纯净的氨气,你认为装置中U型管的作用是
。
⑵ 在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有 性。
⑶ 某同学查阅资料发现Cu2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu2O。已知:① Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+。
② 在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2。
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu2O。(简述操作方法、现象和结论)
![]() ⑷ 现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。下列有关说法正确的是【已知:3Cu2O + 14HNO3(稀) 6Cu(NO3)2 + 2NO↑+ 7H2O】___________
⑷ 现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。下列有关说法正确的是【已知:3Cu2O + 14HNO3(稀) 6Cu(NO3)2 + 2NO↑+ 7H2O】___________
A.加入NaOH溶液的体积为1.2L
B.Cu和Cu2O混合物质量为27.2g
C.混合物完全溶解后溶液中n(H+)=0.3mol
D.将等质量混合物完全还原至少需标准状况下H21.12L
Ⅰ.A、B、C、D均是前四周期元素组成的常见不同单质或化合物。它们之间有如下转化关系:

(1)若A、B、C、D都是氧化物,且A为光导纤维的主要材料,试写出③化学反应方程式: _______???????????? __________
(2)若A、B、C、D均含有同一种常见金属元素,B是黑色磁性固体,D是一种红褐色沉淀,反应②在常见稀酸中进行,C是该反应中生成的唯一盐,反应②的离子方程式是________ _______, C盐水溶液PH______7 (填“>”“<”“ =”)。
(3)若A、B、C、D均含有同一种短周期的金属元素,且B和D在溶液中反应生成沉淀C,则下列判断正确的是______(填“小写”字母)。
a.A可能是一种耐火材料;
b.B的溶液一定呈碱性;
c.C 一定既溶于盐酸又溶于苛性钠溶液;?
若A为金属单质,则用1molA金属制备C,最少需_____mol HCl和_____mol NaOH。
Ⅱ.汽车安全气囊是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的固体粉末释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的固体粉末进行实验。经组成分析,确定该粉末仅含有Na、Fe、N、O四种元素。水溶性实验表明,固体粉末部分溶解。经检测,可溶物为化合物甲,不溶物为红棕色固体,可溶于盐酸。取13.0g化合物甲(摩尔质量为65g/ mol),加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成一种碱性氧化物丙和另一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲受热分解的化学方程式为??????????????????? 。
(2)丙的电子式为??????????? 。
(3)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是??????????? 。
A.KCl??????????? B.KOH?????????? C.Na2S????????????? D.CuO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com