
题目列表(包括答案和解析)
加热时,随温度不断升高,胆矾晶体会不断分解.在以上分解过程中,会生成氧化铜、氧化亚铜、三氧化硫(g)、二氧化硫、氧气和水蒸气等多种不同产物.温度升高至1000℃时,铜元素全部以Cu2O的形式存在于固体中.现将12.5 g CuSO4·5H2O均匀加热,缓慢升温到1000℃,并恒温加热一段时间.
(1)反应过程中,当固体物质全部转化为何种产物时固体产物的质量最少?质量为多少克?
(2)在分解过程中,写出收集到的气体量最多时发生反应的化学方程式.
(3)某同学在实验过程中,获得了3.8 g固体,试计算该固体产物的组成及质量分数.
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在.它的单质和化合物在工农业生产中有着重要的应用.
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得.相关热化学方程式如下:2Ca3(PO4)2(s)+10C(s)![]() 6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)![]() CaSiO3(s) ΔH2=-89.61 kJ·mol-1
CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)![]() 6CaSiO3(s)+P4(s)+10CO(g) ΔH3则ΔH3=________kJ·mol-1.
6CaSiO3(s)+P4(s)+10CO(g) ΔH3则ΔH3=________kJ·mol-1.
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O![]() 20Cu3P+24H3PO4+60H2SO4
20Cu3P+24H3PO4+60H2SO4
60 mol CuSO4能氧化白磷的物质的量是________.
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示.
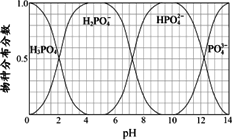
①为获得尽可能纯的NaH2PO4,pH应控制在________;pH=8时,溶液中主要含磷物种浓度大小关系为________.
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是________(用离子方程式表示).
(4)磷的化合物三氯氧磷(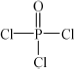 )与季戊四醇(
)与季戊四醇(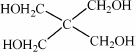 )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X的核磁共振氢谱如下图所示.
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X的核磁共振氢谱如下图所示.

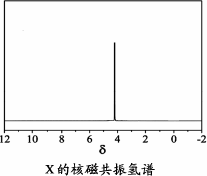
①酸性气体是________(填化学式).
②X的结构简式为________.
三草酸合铁酸钾晶体
K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷.某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究.请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程.限选试剂:浓硫酸、1.0 mol·L-1 HNO3、1.0 mol·L-1盐酸、1.0 mol·L-1 NaOH、3% H2O2、0.1 mol·L-1 KI、0.1 mol·L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是________.
(2)该小组同学阅读资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3.验证固体产物中钾元素存在的方法是________,现象是________.
(3)固体产物中铁元素存在形式的探究.
①提出合理假设
假设1:________;
假设2:________;
假设3:________.
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验.按下表的格式写出实验步骤、预期现象与结论.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com