
题目列表(包括答案和解析)
温度、催化剂不变,向某一固定体积的密闭容器中按下列各物质的量加入H2、N2、NH3,反应达平衡时,氨气浓度最大的一组是( )
|
 2CD(g),是导致 汽车尾气中含有CD的原因之一。T℃时,向容积为2L的密闭容器中充入10 mol C2与5 mol D2,达到平衡后CD的物质的量为2 mol,则T℃时该反应的平衡常数K=
2CD(g),是导致 汽车尾气中含有CD的原因之一。T℃时,向容积为2L的密闭容器中充入10 mol C2与5 mol D2,达到平衡后CD的物质的量为2 mol,则T℃时该反应的平衡常数K=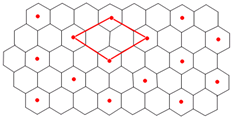
向某密闭容器中加入0.3mol A、0.1mol C和一定量的气体B三种气体,在一定条件下发生反应,各物质浓度随时间变化如下面左图所示。下面右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况且t2—t5四个阶段都各改变一种条件,所用条件均不同。t3—t4阶段为使用催化剂。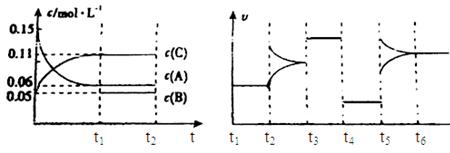
(1)若t1=15s,则t0—t1阶段以C浓度变化表示的反应速率为v(C)= mol/(L?s);
(2)若t2—t3阶段,C的体积分数变小,此阶段v正 v逆(填“大于”、“小于”或“等于”)
(3)B的起始物质的量为 mol;
(4)t1时刻,平衡常数K= ;
(5)t5—t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为a KJ,写出该反应的热化学方程式 ;
(6)若t2时刻后图像变化如下图,则改变条件为 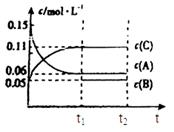
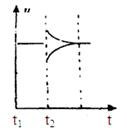
a.恒温恒压下,按照2:1比例充入任意量的B和C
b.恒温恒压下,加入0.24mol A、0.06mol B和0.14mol C
c.恒温恒压下,加入0.12mol A、0.1mol B和0.22mol C
d.恒温恒压下,加入0.14mol B和0.30mol C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com