
题目列表(包括答案和解析)
(1)
已知:N2(g)+O2(g)=2NO(g);ΔH=+180.5 kJ·mol-14NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);ΔH=-905 kJ·mol-1
4NO(g)+6H2O(g);ΔH=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g):ΔH=-483.6 kJ·mol-1
则N2(g)+3H2(g)![]() 2NH3(g)的
2NH3(g)的
(2)在一定条件下,将2 mol N2与5 mol H2混合于一个10 L的密闭容器中,反应情况如图所示:
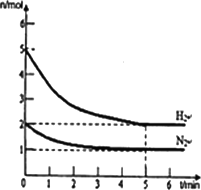
①求5 min内的平均反应速率v(NH3)________;
②达到平衡时NH3的体积分数为________.
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图).钯电极A上发生的电极反应式是________.

(8分)
(1)已知:N2(g)+O2(g)=2NO(g); △H=+180.5 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ·mol-1
2H2(g)十O2(g)=2HO(g):△H=--483.6kJ·mol-1
则N2(g)+3H2(g)2NH3(g)的△H= 。
(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3) ;
②达到平衡时NH3的体积分数为 。
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是 。
(8分)
(1)已知:N2(g)+O2(g)=2NO(g); △H=+180.5 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H="-905" kJ·mol-1
2H2(g)十O2(g)=2HO(g):△H=--483.6 kJ·mol-1
则N2(g)+3H2(g) 2NH3(g)的△H= 。
2NH3(g)的△H= 。
(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3) ;
②达到平衡时NH3的体 积分数为 。
积分数为 。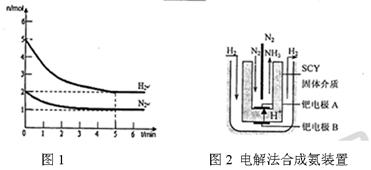
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它 内外
内外 表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A
表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A 上发生的电极反应式是 。
上发生的电极反应式是 。
(1)已知:N2(g)+O2(g)=2NO(g); △H=+180.5 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905 kJ·mol-1
2H2(g)十O2(g)=2H2O(g):△H=--483.6 kJ·mol-1
则N2(g)+3H2(g) ![]() 2NH3(g)的△H= 。
2NH3(g)的△H= 。
(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3) ;
②达到平衡时NH3的体积分数为 。

图1 图2 电解法合成氨装置
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是 。
汽车尾气净化中的一个反应如下:2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)
请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol
C(s)+O2(g) =CO2(g);△H=" -393.5" kJ/mol
2C(s)+O2(g)=2CO(g);△H= -221kJ/mol
则2NO(g)+2CO(g) N2(g) +2CO2(g)的△H=___________。
N2(g) +2CO2(g)的△H=___________。
(2)在一定温度下,在一体积为V升的密闭容器中充入一定量的NO和CO2在t1时刻达到平衡状态,此时n(CO)="a" mol,n(NO)="2a" mol,n(N2)="b" mol,且N2占平衡总体积的1/4。
①则该反应的平衡常数K=_______ ____。(用只含a、V的式子表示)
②判断该反应达到平衡的标志是____ _____
A.v生成(CO2)=v消耗(CO) B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.NO、CO、N2、CO2的浓度均不再变化
③在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在右图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
(3)如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采取的措施是___________
A.降低温度 B.增大压强同时加催化剂
C.升高温度同时充入N2 D.及时将CO2和N2从反应体系中移走
(4)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。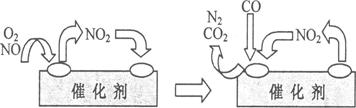
①写出此变化中的总化学反应方程式:________________________________________。
②有人提出,可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染。请你判断是否可行并说出理由:_____________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com