
题目列表(包括答案和解析)
 2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)=0.1mol/L; c (Z)=1.6mol/L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是
2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)=0.1mol/L; c (Z)=1.6mol/L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是 dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:| 压强(Pa) | 4×105 | 6×105 | 10×105 | 20×105 |
| D的浓度(mol/L) | 0.085 | 0.126 | 0.200 | 0.440 |
X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化:
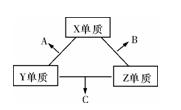
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。
请回答下列问题:
(1)X元素在周期表中的位置是 周期 族。
(2)①C在一定条件下反应生成A的化学方程式是 。
②X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。该盐的水溶液pH 小于 7(填“大于”、“小于”、“等于”),其原因是(写出离子方程式)
。
(3)已知Y单质与Z单质生成C的反应是可逆反应,ΔH<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的有 。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡后,升高温度,C的体积分数增大
硅及其化合物对人类现代文明具有特殊贡献,请回答下列有关问题:
(1)硅原子的结构示意图:________。
(2)下列物品或设备所用的材料属于硅酸盐的是________。
①长江三峡水泥大坝;②石英光导纤维;③陶瓷坩埚;④普通玻璃;⑤硅太阳能电池
A.①②③? ???? B.③④⑤?????? C.②③④? ???? D.①③④
(3)常温下,SiCl4为液态,沸点为57.6℃,在空气中冒白雾。制备高纯度硅的中间产物SiCl4中溶有液态杂质,若要得到高纯度SiCl4,应采用的方法是________;用化学方程式及必要文字解释SiCl4在空气中冒白雾的原因:_______________________________________。
(4)工业上可用SiCl4(g)制备高温结构陶瓷氮化硅,其反应方程式为
3SiCl4(g)+2N2(g)+6H2(g)  Si3N4(s)+12HCl(g) ΔH=a kJ/mol(a<0)
Si3N4(s)+12HCl(g) ΔH=a kJ/mol(a<0)
①该反应的平衡常数表达式K=______________.
②在密闭恒容容器中,能表示上述反应达到平衡状态的是________。
A.3v逆(N2)=v正(H2)
B.v正(HCl=4v正=4v正(SiCl4)
C.混合气体密度保持不变
D.c(N2)∶c(H2)∶c(HCl)=1∶3∶6
③在某条件下达到平衡时,H2与HCl物质的量之比为m∶n;保持其他条件不变,降低温度达到平衡时,H2与HCl物质的量之比________m∶n(填“>”、“=”或“<”)。
8分)一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:2NO2(红棕色) N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动
(填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色
(填“变深”、“变浅”或“不变”)
(12分)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g) CO2(g)+H2(g) △H<0 ,试回答下列问题:
CO2(g)+H2(g) △H<0 ,试回答下列问题:
(1)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
(2)在相同温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com