
题目列表(包括答案和解析)
A.用铂作电极电解MgCl2溶液:
![]()
B.硫氢化钠水解:
HS-+H2O![]() S2-+H3O+
S2-+H3O+
C.硫酸氢钾溶液与过量Ba(OH)2溶液反应:
H++![]() +OH-+Ba2+====BaSO4↓+H2O
+OH-+Ba2+====BaSO4↓+H2O
D.向过量的氨水中滴加少量氯化铝溶液:
Al3++4OH-====![]() +2H2O
+2H2O
 H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH- 
某学生设计了如图所示的“黑笔写红字”的趣味实验。滤纸上先用NaCl和无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹——“ ”。
”。
据此,下列叙述不正确的是( )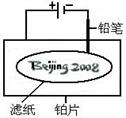
| A.铅笔作阴极:电极反应为:2H+ + 2e- = H2↑ |
| B.铂片作阳极:电极反应为:2Cl-- 2e- = Cl2↑ |
| C.铅笔与滤纸接触处有少量Cl2逸出 |
D.上述反应总的离子方程式可表示为2Cl-+2H2O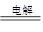 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
某学生设计了如图所示的“黑笔写红字”的趣味实验。滤纸上先用NaCl和无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹——“ ”。
”。
据此,下列叙述不正确的是( )
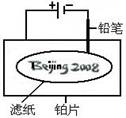
A.铅笔作阴极:电极反应为:2H+ + 2e- = H2↑
B.铂片作阳极:电极反应为:2Cl- - 2e- = Cl2↑
C.铅笔与滤纸接触处有少量Cl2逸出
D.上述反应总的离子方程式可表示为2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com