
题目列表(包括答案和解析)
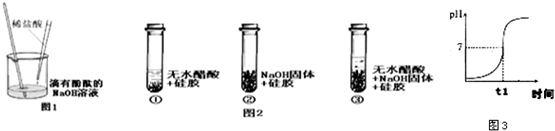
 (2005?海门市)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.
(2005?海门市)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 |
| 溶液温度变化(△t)/℃ | 5.2 | 9.6 | 13.0 | 16.0 | 18.2 |


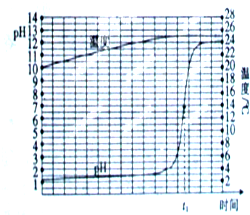 某研究性学习小组对中和反应进行探究,实验方案为取一定量的稀盐酸,逐滴匀速滴加NaOH溶液,用传感器实时获得溶液的PH,温度曲线如图:
某研究性学习小组对中和反应进行探究,实验方案为取一定量的稀盐酸,逐滴匀速滴加NaOH溶液,用传感器实时获得溶液的PH,温度曲线如图:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com