
题目列表(包括答案和解析)
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(s)+O2(g)![]() 2SO3(g).
2SO3(g).
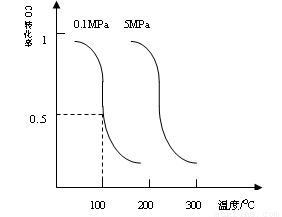
某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:

①将2.0 molSO2和1.0molO2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于__________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
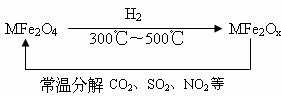
请写出MFe2Ox分解SO2的化学方程式________________(不必配平)。
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
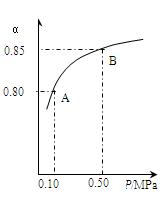
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_____ 。
②平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示)。放出的热量为______ kJ。
(3)新型纳米材料氧缺位铁酸盐
(MFe2Ox 3<x<4,M为Mn、Co、Zn或Ni),是由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
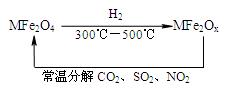
请写出MFe2Ox分解SO2的化学方程式 (不必配平)。
(11分)研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢的课题。
(1)CO可用于合成甲醇。在压强为0.1Mpa条件下,在体积为bL的密闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇:
CO(g)+2H2(g)CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图:
(i)该反应属于_____________反应:(填“吸热”或“放热”)。
(ii)100℃时,该反应的平衡常数:K=_____________;(用a、b的代数式表示)。若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是:_________________填序号)
该反应使用催化剂意义不大;
该反应发生将在很短时间内完成;
该反应达到平衡时至少有一种反应物百分含量很小;
该反应一定是放热反应;
(iii)在温度和容积不变的情况下,再向平衡体系中充入amolCO,2amolH2,达到平衡时CO转化率________(填“增大”,“不变”或“减小”,下同)平衡常数:________。
(iv)在某温度下,向一容积不变的密闭容器中充入2.5molCO,7.5molH2,反应生成CH3OH(g),达到平衡时,CO转化率为90%,此时容器内压强为开始时的压强__________倍。
(2)某温度条件下,若将CO2(g)和H2(g)以体积比1:4混合,在适当压强和催化剂作用下可制得甲烷,已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol
H2(g)+1/2O2(g)= H2O(l) △H=-285.8KJ/mol
则CO2(g)和H2(g)反应生成液态水的热化学方程式为:__________________________________________________________________________。
(11分)研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢的课题。
(1)CO可用于合成甲醇。在压强为0.1Mpa条件下,在体积为bL的密闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇:
CO(g)+2H2(g) CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图: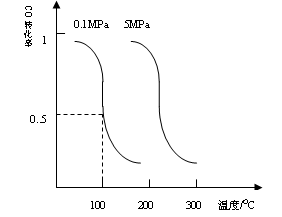
(i)该反应属于_____________反应:(填“吸热”或“放热”)。
(ii)100℃时,该反应的平衡常数:K=_____________;(用a、b的代数式表示)。
若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是:_________________填序号)
| A.该反应使用催化剂意义不大; |
| B.该反应发生将在很短时间内完成; |
| C.该反应达到平衡时至少有一种反应物百分含量很小; |
| D.该反应一定是放热反应; |
(11分)研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢的课题。
(1)CO可用于合成甲醇。在压强为0.1Mpa条件下,在体积为bL的密闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇:
CO(g)+2H2(g) CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图:
(i)该反应属于_____________反应:(填“吸热”或“放热”)。
(ii)100℃时,该反应的平衡常数:K=_____________;(用a、b的代数式表示)。若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是:_________________填序号)
该反应使用催化剂意义不大;
该反应发生将在很短时间内完成;
该反应达到平衡时至少有一种反应物百分含量很小;
该反应一定是放热反应;
(iii)在温度和容积不变的情况下,再向平衡体系中充入amolCO,2amolH2,达到平衡时CO转化率________(填“增大”,“不变”或“减小”,下同)平衡常数:________。
(iv)在某温度下,向一容积不变的密闭容器中充入2.5molCO,7.5molH2,反应生成CH3OH(g),达到平衡时,CO转化率为90%,此时容器内压强为开始时的压强__________倍。
(2)某温度条件下,若将CO2(g)和H2(g)以体积比1:4混合,在适当压强和催化剂作用下可制得甲烷,已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3KJ/mol
H2(g)+1/2O2(g)= H2O(l) △H=-285.8KJ/mol
则CO2(g)和H2(g)反应生成液态水的热化学方程式为:__________________________________________________________________________。
评分说明:
1.试题的参考解答是用来说明评分标准的,考生如用其他方法解答正确的,同样给分;有错的,根据错误的情况,参照评分标准中相应的规定评分。
2.物理计算题只有最后答案而无演算过程的,不给分;只写出一般公式,但未能与试题所给的具体条联系的,不给分。
3.化学方程式、离子方程式未配平的,都不给分。
第I卷
第I卷共18小题,每小题6分,共108分。
一、选择题:选对的得6分,选错或未选的得0分。
1.C 2.B 3.A 4.C 5.D 6.D 7.D 8.B 9.A
10.C 11.C 12.B
二、选择题:全部选对的得6分,选对但不全的得3分,有选错或未选的得0分。
13.A 14.B 15.C 16.AC 17.B 18.AD
第Ⅱ卷
第Ⅱ卷必考部分共9题,共157分。
19.(18分)
(1)① BDE
②探究滑动摩擦力与正压力的关系或测定动摩擦因数;
探究物体运动速度随运动时间变化规律或研究匀变速运动规律;
.files/image325.jpg) 探究物理的加速度与力、质量的关系等。
探究物理的加速度与力、质量的关系等。
(2)①图线如右图所示
.files/image327.gif) 均可)
均可)
②电路图选C
电流表选.files/image115.gif)
变阻器选.files/image122.gif)
20.(15分)
解:(1)人从.files/image152.gif) 点跑到
点跑到.files/image078.gif) 点所用时间为:
点所用时间为:
.files/image333.gif)
汽车从A至B,有:
.files/image335.gif)
代入数据解得:
.files/image337.gif)
21.(19分)
解:(1)运动员离开平台后从A至B在竖直方向有:
.files/image339.gif) ①
①
在B点有:
.files/image341.gif) ②
②
由①②得:
.files/image343.gif) ③
③
(2)运动员从A至C过程有:
.files/image345.gif) ④
④
运动员从C至D过程有:
.files/image347.gif) ⑤
⑤
由③④⑤解得:
.files/image349.gif)
其他正确解法同样给分
22.(20分)
解:(1)当平行金属板.files/image062.gif) 、
、.files/image064.gif) 间不加电压时,设粒子以速度
间不加电压时,设粒子以速度.files/image170.gif) 进入磁场后做匀速圆周运动到达
进入磁场后做匀速圆周运动到达.files/image051.gif) 点,轨迹半径为
点,轨迹半径为.files/image355.gif) ,有
,有.files/image357.gif)
由牛顿第二定律得
.files/image359.gif)
由动能定理有 .files/image361.gif)
得:带电粒子的比荷.files/image363.gif)
(2)设进入磁场时粒子速度为.files/image365.gif) ,它的方向与
,它的方向与.files/image367.gif) 的夹角为
的夹角为.files/image369.gif) ,其射入磁场时的入射点和打到感光片上的位置之间的距离
,其射入磁场时的入射点和打到感光片上的位置之间的距离.files/image371.gif) ,有:
,有:
.files/image373.jpg)
.files/image375.gif)
.files/image377.gif)
由几何关系得:.files/image379.gif)
即.files/image371.gif) 与
与.files/image369.gif) 无关,为定值。
无关,为定值。
则带电粒子在平行金属板.files/image062.gif) 、
、.files/image064.gif) 间的最大偏移量
间的最大偏移量
.files/image385.gif) , 对应的偏转电压
, 对应的偏转电压.files/image387.gif)
由功能关系可知偏移量最大的带电粒子离开平行金属板.files/image062.gif) 、
、.files/image064.gif) 时有最大动能
时有最大动能.files/image391.gif) ,
,
由动能定理
.files/image393.gif)
解得
.files/image395.gif)
同理,.files/image397.gif) 时刻进入平行金属板
时刻进入平行金属板.files/image062.gif) 、
、.files/image064.gif) 间的带电粒子离开平行金属板时有最小动能
间的带电粒子离开平行金属板时有最小动能.files/image401.gif) ,则:
,则:
.files/image403.gif)
故: .files/image405.gif)
23.(15分)
(1).files/image407.jpg)
(2).files/image409.gif) (或
(或.files/image411.gif)
(3).files/image413.gif) (熔融)
(熔融).files/image415.jpg)
.files/image417.gif)
(4).files/image419.gif) 3
3
(5).files/image421.gif) (1)+
(1)+.files/image423.gif)
.files/image425.gif)
.files/image427.gif)
24.(15分)
(1).files/image429.gif)
(2)确保碳酸氢钠完全分解,减少测定误差(或其他合理答案)
(3)洗涤
(4).files/image431.gif) (或其他合理答案)
(或其他合理答案)
(5)偏高
(6)浓硫酸
(7)将B、C装置中的.files/image433.gif) 全部驱入D装置的碱石灰中,减小实验误差
全部驱入D装置的碱石灰中,减小实验误差
25.(15分)
(1)减小;0.0003.files/image435.gif)
(2).files/image437.gif)
(3)①.files/image439.gif) ; ②
; ②.files/image441.gif) ;③增大;不变
;③增大;不变
26.(25分)
I.(15分)
(1).files/image443.gif) (酒精)+
(酒精)+.files/image445.gif) +少量能量
+少量能量
(2)脱落酸
(3)酶的活性 细胞呼吸释放的部分能量转化为热能
(4)增多
(5)光合作用强度大于呼吸作用强度
光照强度、光照时间、温度、.files/image433.gif) 浓度、水肥管理、病虫害、杂草等(答出2项即可)
浓度、水肥管理、病虫害、杂草等(答出2项即可)
Ⅱ.(10分)
(1)取样器取样
(2)群落
竞争、寄生、捕食、互利共生
(3)间接
(4)负反馈调节
27.(15分)
(1)X、Ⅱ、Ⅲ、Ⅳ或Y、Ⅱ、Ⅲ、Ⅳ (答全得3分,不全不得分。“或”不能写成“和”)
(2).files/image448.gif) 或
或.files/image450.gif) 分离
分离
(3).files/image452.gif) 、
、.files/image454.gif) 二
二
第Ⅱ卷选考部分共5题,共35分。其中,第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答,若第28、29题都作答,则按第28题计分,若第30、31题都作答,则按第30题计分;第32题为生物题,是必答题。
28.(12分)
(1)④ (2)②
29.(12分)
(1)② (2)①
30.(13分)
(1)3
(2)C
(3)① 离子键;氢键
②.files/image456.gif)
(4).files/image458.gif) 的
的.files/image316.gif)
.files/image461.gif) 大于
大于.files/image463.gif) 的
的.files/image465.gif) ,所以
,所以.files/image467.gif) 再失去一个电子比
再失去一个电子比.files/image469.gif) 更难,原因是
更难,原因是.files/image471.gif) 属于较稳定的半充满结构。
属于较稳定的半充满结构。
31.(13分)
(1).files/image473.gif)
(2)CD
(3)2:2
(4).files/image475.gif)
(5).files/image477.jpg)
32.(10分)
(1)构件基因表达载体
农杆菌转化法、基因枪法、花粉管通道法
抗原-抗体杂交
(2)植物组织培养
植物细胞的全能性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com