
题目列表(包括答案和解析)
由组成原电池的两电极材料判断:一般是活泼的金属为________,活泼性较弱的金属或非金属为________.
原电池的正负极的判断:
①由组成原电池的两极材料判断。一般是 的金属为负极,活泼性 的金属或能 的非金属为正极。
②根据电流方向或电子流动方向判断。电流是由 流向 ;电子流动方向是由 极流向 极。
③根据原电池里电解质溶液内离子的定向流动方向。在原电池的电解质溶液内,阳离子移向的极是 极,阴离子移向的极为 极。
④根据原电池两极发生的变化来判断。原电池的负极总是 电子发生氧化反应,其正极总是 电子发生 反应。
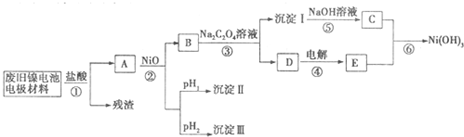
| M(OH)n | Kap | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com